Voir le courrier touchant cet article.
Sommaire
La nécrose pulpaire est une séquelle peu fréquente de la luxation en extrusion de dents immatures dont la fermeture apicale est incomplète. Dans cet article, nous décrivons la prise en charge d'incisives supérieures immatures fortement extrudées, ainsi que le résultat de la revascularisation utilisée pour traiter la nécrose pulpaire qui a suivi. Un garçon de 8,5 ans, qui avait subi un grave traumatisme dento-alvéolaire dans la région antérieure supérieure à la suite d'une chute, a reçu un traitement d'urgence qui a consisté en la réduction de l'os cortical labial déplacé et en le repositionnement des incisives centrales ayant subi une luxation en extrusion. Lorsque le garçon est revenu une semaine plus tard se plaignant d'une douleur spontanée au niveau des incisives traumatisées, le traitement suivant lui a été dispensé : revascularisation par irrigation à l'hypochlorite de sodium, suivie de l'application intracanalaire d'hydroxyde de calcium pendant 3 semaines et de la mise en place d'un bouchon coronaire fait d'agrégat minéral de trioxyde (mineral trioxide aggregate, MTA) et de résine composite. Une guérison périradiculaire complète a été observée après 3 mois, laquelle a été suivie d'un épaississement progressif des parois canalaires et d'une fermeture apicale. Les observations de suivi ont confirmé l'efficacité du traitement de régénération comme solution de rechange viable à l'apexification classique pour les dents immatures traumatisées avec atteinte pulpaire.
Introduction
L'extrusion est un traumatisme qui se caractérise par le déplacement axial partiel d'une dent1. Sur le plan clinique, la dent atteinte semble allongée; elle est habituellement déplacée en direction linguale et est excessivement mobile2,3. À la radiographie, l'espace du ligament parodontal de la dent extrudée semble élargi. Se basant sur la rupture du ligament parodontal n'ayant pas encore été exposé à la dessiccation ou sur la désarticulation de la dent de son apport sanguin, Andreasen4 a décrit la luxation en extrusion d'«avulsion partielle». Selon Lee et ses collègues3, cette expression est utile à des fins de traitement, car les effets pulpaires d'une grave extrusion peuvent se comparer à ceux d'une dent réimplantée.
Le stade du développement apical est un facteur déterminant de la guérison pulpaire après une luxation en extrusion3,5,6. Sur les dents à apex ouvert, la probabilité de guérison de la pulpe est plus élevée et la guérison est généralement suivie d'une oblitération du canal radiculaire. En revanche, la probabilité de revascularisation de la pulpe est faible sur les dents à apex fermé et il y a habituellement nécrose pulpaire1,3,5,6. Lorsqu'un diagnostic de nécrose pulpaire est posé, un traitement endodontique devrait être instauré pour éliminer l'infection et favoriser la cicatrisation et la préservation de la dent3. Si le développement radiculaire est incomplet, une apexification est indiquée pour induire la formation d'une barrière calcifiée à l'apex. Cette technique comporte toutefois plusieurs inconvénients qui ont trait notamment à la durée du traitement (jusqu'à 24 mois), lequel requiert souvent de multiples visites et le remplacement du pansement intracanalaire7,8. De plus, il est impossible de prévoir la fermeture apicale9 et la dent devient sensible aux fractures radiculaires après une exposition prolongée à l'hydroxyde de calcium [Ca(OH)2]10,11. À cause de ces problèmes, la technique classique d'apexification par le Ca(OH)2 a été modifiée par la création d'une barrière apicale artificielle de MTA12–15. L'obturation des apex ouverts par des bouchons de MTA réduit considérablement la durée du traitement et favorise la guérison des tissus périradiculaires12,14,16,17. Cependant, les bouchons de MTA ne peuvent stimuler la fermeture physiologique de l'apex ni l'épaississement de la dentine radiculaire; l'intégrité structurale de la dent est donc compromise18,19.
La revascularisation est un nouveau traitement endodontique de régénération qui vise à maintenir le développement radiculaire et la régénération des tissus sur des dents immatures nécrosées20,21. Le canal radiculaire est désinfecté avec de l'hypochlorite de sodium, puis un médicament (p. ex., hydroxyde de calcium ou mélange de ciprofloxacine, métronidazole et minocycline) est appliqué à l'intérieur du canal22. Après la désinfection, la pâte antibiotique est retirée et un saignement apical est induit pour qu'il y ait formation d'un caillot sous le niveau coronaire. L'orifice du canal radiculaire est ensuite scellé avec du MTA et la couronne de la dent est restaurée de façon permanente.
Ce protocole s'est avéré efficace, comme en témoignent les différents niveaux d'allongement de la racine, d'épaississement des parois canalaires et de fermeture apicale qui ont été observés23–28. Dans le cas qui suit, nous décrivons la prise en charge d'incisives supérieures immatures fortement extrudées, ainsi que le résultat de la revascularisation dans le traitement de la nécrose pulpaire consécutive au traumatisme.
Étude de cas
Un garçon de 8,5 ans en bonne santé a été admis à la clinique de dentisterie pédiatrique 6 heures après avoir fait une chute dans la cour d'école. Selon le rapport, un examen d'urgence a été pratiqué par un pédiatre de l'hôpital qui a indiqué que le patient ne présentait pas de symptômes neurologiques ni de symptômes physiques généraux et qui a dirigé le patient pour le traitement de son traumatisme dento-alvéolaire.
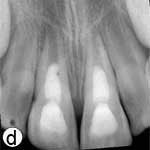
L'enfant était incapable de fermer la bouche ou de parler correctement à cause du déplacement marqué des incisives centrales supérieures, visible à l'évaluation extrabuccale (ill. 1a). L'examen intrabuccal a révélé une importante luxation en extrusion des incisives ainsi qu'une fracture de l'os cortical labial (ill. 1b). Les dents étaient très mobiles et l'incisive centrale supérieure droite était fortement déplacée en direction linguale. Le segment lingual de l'os alvéolaire était légèrement mobile à la palpation, mais ne semblait pas déplacé. Les incisives latérales adjacentes présentaient une mobilité normale. La gencive attachée au distal de l'incisive latérale droite était lacérée (ill. 1b). Une radiographie rétroalvéolaire a révélé un élargissement de l'espace du ligament parodontal apical sur les 2 incisives, ainsi qu'un déplacement de l'incisive centrale droite en direction linguale (ill. 1c). Le développement radiculaire était incomplet sur les 2 dents, qui présentaient de larges canaux radiculaires et de larges apex ouverts.
Après avoir irrigué abondamment avec du sérum physiologique pour retirer le caillot (ill. 1d), l'os cortical buccal déplacé a été replacé délicatement. Les incisives extrudées ont ensuite été repositionnées avec soin par la manœuvre digitale classique, et on n'a observé aucun signe de résistance due à un blocage par un caillot. Une attelle semi-rigide faite d'une ligne de pêche monofilament de 0,9 mm de diamètre a été fixée aux incisives latérales et centrales avec une résine composite mordancée (ill. 1e). Après la suture des lacérations des tissus mous, une radiographie a été prise pour confirmer que la réduction et le positionnement avaient été bien faits (ill. 1f). De l'amoxicilline et de l'ibuprofène ont été prescrits au patient à qui l'on a fixé un rendez-vous de suivi.
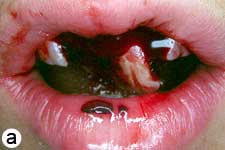
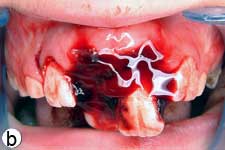
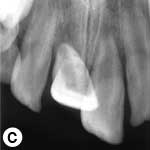
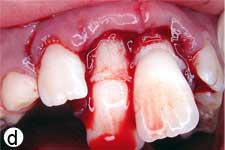

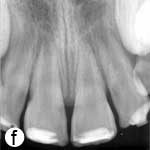
Ill. 1 : Examen initial du patient. a) Vue extrabuccale montrant l'étendue de la fermeture de la mâchoire. b) Vue intrabuccale. c) Vue radiographique des incisives extrudées. d) Vue intrabuccale après l'enlèvement du caillot par irrigation avec du sérum physiologique. e) Vue des incisives après réduction, mise en place de l'attelle et suture. f) Vue radiographique des incisives après leur repositionnement, révélant les larges canaux radiculaires et apex ouverts.
Une semaine plus tard, le patient est revenu se plaignant d'une douleur spontanée intense au niveau des incisives traumatisées. Les dents étaient sensibles à la palpation et l'examen radiographique a révélé des zones périapicales radioclaires. Comme le développement radiculaire était incomplet et que les dents présentaient de larges apex ouverts, le traitement endodontique classique par apexification avec du Ca(OH)2 ou la mise en place d'une barrière apicale de MTA risquaient de compromettre grandement l'intégrité structurale des dents. Un traitement endodontique de régénération a donc été envisagé pour les incisives atteintes. Après avoir discuté en détail des risques et des résultats possibles de ce traitement, ainsi que du plan de traitement en cas d'échec, on a obtenu le consentement du patient et des parents et le traitement a été amorcé le jour même.
Après l'anesthésie, un accès aux chambres pulpaires a été pratiqué. La zone a été isolée avec des rouleaux de coton et des gazes, car la présence de l'attelle rendait impossible la mise en place d'une digue. L'orifice de chaque canal a été irrigué doucement avec 10 ml d'hypochlorite de sodium (NaOCl) à 2,5 %, sans utiliser d'instruments de mise en forme canalaire. Le Ca(OH)2 en poudre (Merck, Darmstadt, Allemagne) a été mélangé avec du sérum physiologique stérile dans une proportion de 3:1 de manière à obtenir une pâte homogène épaisse. Le mélange a été appliqué dans la chambre pulpaire avec un instrument de plastique et a été délicatement compacté dans la portion coronaire des canaux radiculaires à l'aide de boulettes de coton humides. Enfin, la cavité d'accès a été scellée avec du Cavit (3M ESPE, Seefeld, Allemagne) (ill. 2a). Le patient est revenu une semaine plus tard pour faire retirer l'attelle et, 3 semaines plus tard, pour l'évaluation du médicament intracanalaire.
Après 3 semaines, les 2 dents étaient asymptomatiques. Après l'administration de l'anesthésique mépivacaïne à 2 % (Citanest, AstraZeneca, Royaume-Uni) sans vasoconstricteur, les dents ont été isolées avec une digue et un nouvel accès a été pratiqué. La pâte de Ca(OH)2 a été retirée en irriguant abondamment avec du NaOCl à 2,5 %; les canaux radiculaires ont ensuite été irrigués une dernière fois avec 10 ml de sérum physiologique stérile puis séchés. Un saignement apical a été induit en pratiquant une légère irritation avec des limes K de calibre 15. Après la formation d'un caillot, le MTA (Dentsply Tulsa Dental, Tulsa, OK) a été préparé conformément aux instructions du fabricant et a été appliqué doucement sur le caillot. Une boulette de coton humide a été placée sur le MTA et la cavité d'accès a été temporairement restaurée avec un ciment de verre ionomère classique. Les restaurations finales en résine composite ont été mises en place une semaine plus tard (ill. 2b), et des visites de suivi régulières ont été fixées.
Les dents sont demeurées asymptomatiques durant toute la période d'évaluation de 18 mois. À 3 mois, la guérison périapicale était complète et le développement radiculaire et la fermeture des apex s'étaient poursuivis (ill. 2c).
Afin de quantifier l'accroissement de la largeur et de la longueur de la racine, les radiographies prises immédiatement après le traitement et 18 mois plus tard ont été converties en des fichiers TIFF 32 bits à l'aide du programme d'analyse ImageJ (v.1.44p, National Institutes of Health, Bethesda, MD). Le module d'extension TurboReg (Biomedical Imaging Group, École polytechnique fédérale de Lausanne, Lausanne, Suisse)29 a été utilisé pour l'alignement mathématique des 2 images, selon la méthode décrite par Bose et ses collègues28. Comme la radiographie prise à 18 mois présentait moins de distorsion, elle a été utilisée comme image «source», alors que la radiographie postopératoire qui nécessitait des corrections a servi d'image «cible»28. Après l'alignement des images à l'aide de TurboReg (ill. 2d), une échelle a été ajoutée pour mesurer la longueur de la racine et l'épaisseur des parois canalaires28. Ces mesures ont révélé des augmentations de 18,16 % et de 17,14 % de la longueur des racines, et de 40,54 % et de 75,64 % de la largeur des parois, respectivement sur les incisives droite et gauche.
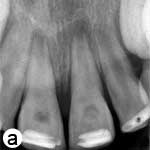
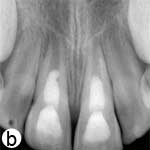
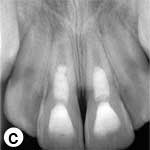
Ill. 2 : a) Vue radiographique des dents après l'application intracanalaire d'une pâte d'hydroxyde de calcium [Ca(OH)2]; on remarque des zones périradiculaires radioclaires dans les 2 racines. b) Radiographie rétroalvéolaire montrant la barrière coronaire d'agrégat minéral de trioxyde (MTA) et la restauration finale en composite. c) Vue radiographique au moment du suivi après 18 mois, montrant le rétrécissement du canal radiculaire dans le tiers apical et l'épaississement des parois latérales. On remarque que l'architecture osseuse est normale dans la région périradiculaire. d) Image b après correction (alignement) à l'aide du programme ImageJ et du module d'extension TurboReg, en utilisant c comme image «source» à des fins de correction mathématique.
À 12 mois, une réponse positive a été observée au test au froid, mais la réponse au test électrique de vitalité pulpaire sur les 2 dents a été irrégulière. À 18 mois, la réponse au test au froid était toujours positive, mais une réponse différée uniforme au test de stimulation électrique a été observée sur les 2 dents. Le patient a fait l'objet de visites de suivi régulières; ses dents sont demeurées asymptomatiques, avec une mobilité normale et des gencives en bon état.
Discussion
La nécrose pulpaire est une séquelle relativement peu fréquente de la luxation en extrusion de dents immatures à larges apex ouverts5, en raison de la forte probabilité de revascularisation de ces dents et du développement subséquent de leur racine. Le risque de nécrose augmente toutefois de façon considérable dans les cas d'extrusion marquée3 et, s'il y a nécrose pulpaire, il est probable qu'elle surviendra tôt3,5,30.
Les techniques endodontiques de régénération peuvent favoriser le développement continu de la racine21 et offrir ainsi une solution de rechange pour la prise en charge de dents permanentes immatures traumatisées avec nécrose pulpaire et infection périradiculaire24,31. De plus en plus de données laissent croire à la présence de tissus pulpaires viables résiduels dans le large canal radiculaire ou la région apicale des dents immatures nécrosées, lesquels tissus pourraient résister à l'infection et favoriser la poursuite du développement de l'apex25,32,33. Les cellules souches de la papille apicale peuvent elles aussi survivre à l'infection, en raison de leur proximité avec les tissus parodontaux26,32,33. Après une désinfection endodontique adéquate, ces cellules peuvent se différencier sous l'influence des cellules de la gaine épithéliale de Hertwig ayant survécu et favoriser la poursuite du développement de la racine26,33. Après l'induction du processus de régénération, la présence d'un large foramen apical et d'un large canal radiculaire favorise le développement des petits vaisseaux sanguins et des tissus régénérés26.
Durant le protocole de revascularisation, il convient de privilégier le traitement le plus conservateur possible des canaux radiculaires infectés20,25,31, et la meilleure option à cette fin consiste en une irrigation abondante avec du NaOCl à 2,5 % à 5,25 % sans utiliser d'instruments de mise en forme canalaire. Durant la même visite, un médicament est appliqué à l'intérieur du canal et laissé en place pendant 3 à 4 semaines pour désinfecter le canal. Des rapports précédents ont démontré l'efficacité d'une pâte antibiotique triple composée de métronidazole, de ciprofloxacine et de minocycline pour la désinfection des canaux radiculaires infectés22,34, y compris les canaux de dents immatures avec parodontite apicale25,35. Le principal inconvénient de cette pâte tient à la décoloration coronaire induite par la minocycline36,37, un phénomène qui peut cependant être atténué – mais non éliminé – par le scellement préalable de la dentine coronaire par un adhésif37.
Le Ca(OH)2 a aussi été utilisé avec succès pour la désinfection des canaux radiculaires avant la revascularisation23,26,28. Bose et ses collègues28 ont ainsi montré que l'application de Ca(OH)2 dans la moitié coronaire du canal a favorisé un accroissement de la longueur de la racine et de l'épaisseur des parois, qui a été supérieur aux résultats obtenus avec la pâte antibiotique triple.
Dans le cas présent, les dents étaient asymptomatiques après le traitement au Ca(OH)2 : le développement de la racine s'est poursuivi et aucun symptôme d'infection ni aucune décoloration coronaire n'ont été observés. Dans le cadre d'une étude rétrospective, Chueh et ses collègues26 ont constaté un taux élevé de calcification progressive du canal radiculaire dans les dents traitées au Ca(OH)2, ce qui laisse croire que le développement radiculaire induit par le traitement endodontique de régénération ne suivrait peut-être pas un schéma naturel. Par conséquent, même s'il n'y a pas eu oblitération du canal radiculaire dans le cas présent, il pourrait y avoir calcification progressive à plus long terme.
Des études précédentes sur la revascularisation d'incisives immatures traumatisées font état d'une absence de sensibilité au test à froid et au test électrique de vitalité pulpaire24,30,38. En l'absence de données histologiques chez les humains, il convient d'interpréter avec prudence les raisons pouvant expliquer les réponses positives et négatives obtenues aux tests thermique et électrique de vitalité, car l'absence de réponse pourrait simplement être attribuable à l'épaisseur du MTA et des matériaux de restauration empêchant la stimulation des tissus vivants à l'intérieur du canal radiculaire39. L'utilisation d'une matrice de collagène pour contrôler l'épaisseur de la barrière coronaire de MTA30 et la mise en place de la barrière de MTA à proximité de la jonction amélocémentaire39 pourrait accroître la possibilité de réponse positive, à la condition de préserver l'innervation des tissus régénérés à l'intérieur du canal radiculaire. Sur la base de ces considérations, l'absence de cohérence entre la réponse des incisives extrudées au test à froid et au test électrique pourrait s'expliquer par l'épaisseur des barrières de MTA qui occupaient près de la moitié de la longueur du canal radiculaire.
Les résultats favorables obtenus à court terme dans ce cas de luxation en extrusion sévère montrent que le traitement endodontique de régénération sur des dents immatures traumatisées avec atteinte pulpaire est une solution de rechange viable à l'apexification ou à l'application de barrières artificielles à l'apex. Bien que la nature des tissus régénérés à l'intérieur du canal radiculaire reste à élucider chez les humains, il ne fait pas de doute que cette technique peut favoriser la poursuite du développement radiculaire et de la fermeture apicale. D'autres données cliniques devront être recueillies pour confirmer la prévisibilité de ce traitement.
LES AUTEURS
Références
- Andreasen JO, Andreasen FM, Bakland LK, Flores MT. Traumatic dental injuries: a manual. 1st ed. Copenhagen: Munksgaard; 2000. p. 34-5.
- Andreasen FM Andreasen JO. Luxation injuries. In: Andreasen JO, Andreasen FM, editors. Textbook and color atlas of traumatic injuries to the teeth. 3rd ed. Copenhagen: Monksgaard; 1994. p. 318.
- Lee R, Barrett EJ, Kenny DJ. Clinical outcomes for permanent incisor luxations in a pediatric population. II. Extrusions. Dent Traumatol. 2003;19(5):274-9.
- Andreasen JO. Luxation of permanent teeth due to trauma. A clinical and radiographic follow-up study of 189 injured teeth. Scand J Dent Res. 1970;78(3):273-86.
- Andreasen FM, Pedersen BV. Prognosis of luxated permanent teeth — the development of pulp necrosis. Endod Dent Traumatol. 1985;1(6):207-20.
- Andreasen FM, Zhijie Y, Thomsen BL. Relationship between pulp dimensions and development of pulp necrosis after luxation injuries in the permanent dentition. Endod Dent Traumatol. 1986;2(3):90-8.
- Cvek M. Prognosis of luxated non-vital incisors treated with calcium hydroxide and filled with gutta-percha. A retrospective clinical study. Endod Dent Traumatol. 1992;8(2):45-55.
- Abbot PV. Apexification with calcium hydroxide — when should the dressing be changed? The case for regular dressing changes. Aust Endod J. 1998;24(1):27-32.
- Rafter M. Apexification: a review. Dent Traumatol. 2005;21(1):1-8.
- Andreasen JO, Farik B, Munksgaard EC. Long-term calcium hydroxide as a root canal dressing may increase risk of root fracture. Dent Traumatol. 2002;18(3):134-7.
- Doyon GE, Dumsha T, von Fraunhofer JA. Fracture resistance of human root dentin exposed to intracanal calcium hydroxide. J Endod. 2005;31(12):895-7.
- Mente J, Hage N, Pfefferle T, Koch JM, Dreyhaupt J, Staehle HJ, et al. Mineral trioxide aggregate apical plugs in teeth with open apical foramina: a retrospective analysis of treatment outcome. J Endod. 2009;35(10):1354-8.
- Simon S, Rilliard F, Berdal A, Machtou P. The use of mineral trioxide aggregate in one-visit apexification treatment: a prospective study. Int Endod J. 2007;40(3):186-97.
- Holden DT, Schwartz SA, Kirkpatrick TC, Schindler WG. Clinical outcomes of artificial root-end barriers with mineral trioxide aggregate in teeth with immature apices. J Endod. 2008;34(7):812-7.
- Witherspoon DE, Small JC, Regan JD, Nunn M. Retrospective analysis of open apex teeth obturated with mineral trioxide aggregate. J Endod. 2008;34(10):1171-6. Epub 2008 Aug 13.
- Sarris S, Tahmassebi JF, Duggal MS, Cross IA. A clinical evaluation of mineral trioxide aggregate for root-end closure of non-vital immature permanent incisors in children — a pilot study. Dent Traumatol. 2008;24(1):79-85.
- Cehreli ZC, Sara S, Uysal S, Turgut MD. MTA apical plugs in the treatment of traumatized immature teeth with large periapical lesions. Dent Traumatol. 2011;27(1):59-62. Epub 2010 Dec 5.
- Huang GT. Apexification: the beginning of its end. Int Endod J. 2009;42(10):855-66. Epub 2009 June 22.
- Wang X, Thibodeau B, Trope M, Lin LM, Huang GT. Histologic characterization of regenerated tissues in canal space after the revitalization/revascularization procedure of immature dog teeth with apical periodontitis. J Endod. 2010;36(1):56-63.
- Banchs F, Trope M. Revascularization of immature permanent teeth with apical periodontitis: new treatment protocol? J Endod. 2004;30(4):196-200.
- Murray PE, Garcia-Godoy F, Hargreaves KM. Regenerative endodontics: a review of current status and a call for action. J Endod. 2007;33(4):377-90. Epub 2007 Feb 20.
- Hoshino E, Kurihara-Ando N, Sato I, Uematsu H, Sato M, Kota K, et al. In-vitro antibacterial susceptibility of bacteria taken from infected root dentine to a mixture of ciprofloxacin, metronidazole and minocycline. Int Endod J. 1996;29(2):125-30.
- Chueh LH, Huang GT. Immature teeth with periradicular periodontitis or abscess undergoing apexogenesis: a paradigm shift. J Endod. 2006;32(12):1205-13. Epub 2006 Oct 13.
- Cotti E, Mereu M, Lusso D. Regenerative treatment of an immature, traumatized tooth with apical periodontitis: report of a case. J Endod. 2008;34(5):611-6.
- Jung IY, Lee SJ, Hargreaves KM. Biologically based treatment of immature permanent teeth with pulpal necrosis: a case series. J Endod. 2008;34(7):876-87. Epub 2008 May 16.
- Chueh LH, Ho YC, Kuo TC, Lai WH, Chen YH, Chiang CP. Regenerative endodontic treatment for necrotic immature permanent teeth. J Endod. 2009;35(2):160-4. Epub 2008 Dec 12.
- Ding RY, Cheung GS, Chen J, Yin XZ, Wang QQ, Zhang CF. Pulp revascularization of immature teeth with apical periodontitis: a clinical study. J Endod. 2009;35(5):745-9.
- Bose R, Nummikoski P, Hargreaves K. A retrospective evaluation of radiographic outcomes in immature teeth with necrotic root canal systems treated with regenerative endodontic procedures. J Endod. 2009;35(10):1343-9. Epub 2009 Aug 15.
- Thévenaz P, Ruttimann UE, Unser M. A pyramid approach to subpixel registration based on intensity. IEEE Trans Image Process. 1998;7(1):27-41.
- Jacobsen I. Criteria for diagnosis of pulp necrosis in traumatized permanent incisors. Scand J Dent Res. 1980;88(4):306-12.
- Petrino JA, Boda KK, Shambarger S, Bowles WR, McClanahan SB. Challenges in regenerative endodontics: a case series. J Endod. 2010;36(3):536-41. Epub 2009 Dec 6.
- Sonoyama W, Liu Y, Yamaza T, Tuan RS, Wang S, Shi S, et al. Characterization of the apical papilla and its residing stem cells from human immature permanent teeth: a pilot study. J Endod. 2008;34(2):166-71.
- Huang GT, Sonoyama W, Liu Y, Liu H, Wang S, Shi S. The hidden treasure in apical papilla: the potential role in pulp/dentin regeneration and bioroot engineering. J Endod. 2008;34(6):645–51.
- Sato I, Ando-Kurihara N, Kota K, Iwaku M, Hoshino E. Sterilization of infected root-canal dentine by topical application of a mixture of ciprofloxacin, metronidazole and minocycline in situ. Int Endod J. 1996;29(2):118-24.
- Windley W 3rd, Teixeira F, Levin L, Sigurdsson A, Trope M. Disinfection of immature teeth with a triple antibiotic paste. J Endod. 2005;31(6):439-43.
- Reynolds K, Johnson JD, Cohenca N. Pulp revascularization of necrotic bilateral bicuspids using a modified novel technique to eliminate potential coronal discolouration: a case report. Int Endod J. 2009;42(1):84-92.
- Kim JH, Kim Y, Shin SJ, Park JW, Jung IY. Tooth discoloration of immature permanent incisor associated with triple antibiotic therapy: a case report. J Endod. 2010;36(6):1086-91.
- Thibodeau B. Case report: pulp revascularization of a necrotic, infected, immature, permanent tooth. Pediatr Dent. 2009;31(2):145-8.
- Torabinejad M, Turman M. Revitalization of tooth with necrotic pulp and open apex by using platelet-rich plasma: a case report. J Endod. 2011;37(2):265-8.
