Sommaire
Avec l’usage croissant des bisphosphonates, les professionnels dentaires observent de plus en plus de cas d’ostéonécrose de la mâchoire associée aux bisphosphonates (ONMB). Le dosage du télopeptide C‑terminal (CTX) réticulé est un test sérologique qui est utilisé pour prévoir le risque d’ONMB. Cet article examine l’efficacité du CTX comme marqueur biochimique de l’ONMB, ainsi que l’utilité de ce test pour les dentistes appelés à établir un plan de traitement approprié pour les patients qui prennent ou qui ont pris des bisphosphonates. Il présente également d’autres moyens d’évaluer le risque d’ONMB et inclut deux études de cas (étude de cas no 1, étude de cas no 2) illustrant la planification du traitement dentaire chez des patients traités avec des bisphosphonates, en regard de taux précis de CTX.
Un examen des bisphosphonates
Depuis l’introduction des bisphosphonates en 19691, le nombre de patients qui prennent cette classe de médicaments a augmenté rapidement et de façon importante. À preuve, depuis la mise en marché de l’alendronate, du risédronate et de l’ibandronate, plus de 225 millions d’ordonnances de ces trois médicaments ont été rédigées aux États-Unis2, dont 27 millions en 2008 seulement1. Cette utilisation croissante a permis aux chercheurs et aux cliniciens d’en apprendre davantage sur les indications thérapeutiques, les modes d’action, les effets positifs et les réactions indésirables de ces médicaments. L’ostéonécrose de la mâchoire associée aux bisphosphonates (ONMB) est une des réactions indésirables graves liées à la prise de ces médicaments. Le présent article examine l’efficacité d’un marqueur biochimique sérologique – le télopeptide C‑terminal (CTX) réticulé – comme prédicteur de l’apparition de l’ONMB et examine l’influence qu’a le dosage du CTX sur les dentistes durant la planification et l’exécution des traitements dentaires.
Aspects cliniques du traitement aux bisphosphonates
Les bisphosphonates sont habituellement prescrits pour freiner le renouvellement des cellules osseuses. Ces médicaments inhibent la résorption osseuse en agissant sur les ostéoclastes3,4. Selon la pharmacodynamie, ces médicaments suppriment l’activation des ostéoclastes et en induisent l’apoptose5. Les ostéoclastes résorbent les os qui contiennent des ostéocytes morts ou vieux et les microfractures, et ce processus donne lieu à la libération de médiateurs chimiques de l’ostéogenèse tels que les cytokines, la protéine morphogénétique osseuse et les facteurs de croissance 1 et 2 analogues à l’insuline6. Les effets inhibiteurs des bisphosphonates sur les ostéoclastes empêchent donc le remodelage, la réparation et la régénération osseux. La première génération de bisphosphonates, parmi lesquels figurent l’étidronate et le clodronate par voies orale et intraveineuse (i.v.), ne contenait pas d’azote. Ces médicaments sont aujourd’hui moins utilisés en clinique, car ils sont moins puissants que les médicaments plus récents de cette classe1. Les bisphosphonates sans azote forment des métabolites cytotoxiques de l’adénosine triphosphate (ATP), ce qui a pour effet d’interrompre l’activité métabolique intracellulaire4. Les bisphosphonates avec azote sont aujourd’hui plus largement utilisés en clinique, tant sous forme orale que sous forme i.v. Ces médicaments agissent en inhibant la voie du mévalonate, ce qui entraîne le dysfonctionnement et l’apoptose des ostéoclastes. Il convient de souligner que les bisphosphonates par voies orale et i.v. diffèrent considérablement quant à leurs propriétés et à leur demi-vie et aux séquelles qui peuvent y être associées. Le pamidronate et le zolédronate sont deux bisphosphonates administrés par voie i.v. Parmi les bisphosphonates par voie orale, mentionnons l’alendronate, le risédronate et l’ibandronate3,4,6.
Les bisphosphonates sont notamment indiqués pour le traitement du myélome multiple, du cancer du sein métastatique7, de l’ostéoporose et de l’ostéopénie5,8,9, de la maladie de Paget3 ainsi que des métastases osseuses consécutives à un cancer de la prostate, à un cancer du poumon ou à un hypernéphrome10. Les indications pédiatriques incluent l’ostéogenèse imparfaite, l’ostéoporose juvénile idiopathique et l’ostéopénie associée à la polyarthrite rhumatoïde4. Certains auteurs attribuent également à ces médicaments de possibles effets antitumoraux, attribuables à l’apoptose des cellules tumorales et à l’inhibition de l’invasion et de l’adhésion des tumeurs11. La forme orale à plus faible dose est généralement utilisée pour prévenir les fractures chez les patients atteints d’ostéoporose, alors que la forme i.v. plus puissante est largement prescrite pour le traitement du myélome multiple, de la maladie de Paget et de carcinomes métastatiques3,9,10,12-14. Cette classe de médicaments a un profil d’effets indésirables qui lui est propre et qui varie en fonction du médicament, de la voie d’administration, de la posologie, de la durée du traitement et de la fréquence d’administration. Parmi les réactions indésirables fréquentes, mentionnons des effets sur les voies digestives supérieures (p. ex. douleur abdominale, nausées, dyspepsie, constipation et diarrhée), sur l’appareil musculo-squelettique (p. ex. ostéalgie, myalgie, arthralgie ou crampe) et sur le système nerveux (p. ex. maux de tête, étourdissements). Les mises en garde et précautions font notamment mention de ce qui suit : insuffisance rénale, fractures atypiques du fémur, fibrillation auriculaire, carences minérales et ONMB15-17. L’ONMB, qui est l’objet du présent article, revêt une grande importance en dentisterie.
Selon les estimations, la fréquence de l’ONMB après une extraction dentaire varie de 0,09 % à 0,34 % chez les patients prenant des bisphosphonates par voie orale et de 6,7 % à 9,1 % chez ceux traités avec des bisphosphonates i.v.3,12. Parmi les cas déclarés d’ONMB, environ 94 % ont été diagnostiqués chez des patients traités avec des bisphosphonates i.v.18. L’incidence accrue d’effets indésirables associés aux bisphosphonates i.v. pourrait être attribuable à la pharmacocinétique de ces médicaments à leur site d’action. La forme orale n’a une biodisponibilité que de 0,64 %6,8 et l’ONMB serait 500 fois moins fréquente lors de l’utilisation de bisphosphonates par voie orale que de bisphosphonates i.v. à doses élevées13. Les risques accrus associés aux formes i.v. pourraient être attribuables à la longue demi-vie des bisphosphonates (> 10 ans), à l’accumulation rapide des bisphosphonates i.v. dans leur site d’action et au court-circuitage de l’effet de premier passage des médicaments par voie orale. De plus, la forte accumulation des bisphosphonates i.v. dans les os réduit les chances de rétablissement des ostéoclastes; le traitement et la guérison de l’ONMB pourraient donc être plus difficiles que lors de l’utilisation de bisphosphonates par voie orale6. Il convient toutefois de noter que le risque d’ONMB varie même entre les différentes préparations par voie orale. Ainsi, l’alendronate semble avoir une plus grande affinité pour les tissus osseux que d’autres bisphosphonates par voie orale. L’alendronate est également plus puissant et, plus important encore, il est plus souvent prescrit; il est donc plus souvent la cause de l’ONMB18. Parmi les bisphosphonates i.v., le zolédronate est celui qui est le plus souvent associé à l’ONMB14. Selon Marx et ses collègues6, l’alendronate par voie orale est aussi puissant que le pamidronate i.v.
Malgré le risque inhérent d’ONMB associé à la prise de bisphosphonates, il est important d’insister sur l’efficacité de ces médicaments dans des scénarios cliniques précis. À titre d’exemple, il a été démontré que le zolédronate réduit l’incidence des fractures des vertèbres, de la hanche et d’autres fractures, dans des proportions respectives de 70 %, 41 % et 25 %3. De plus, le nombre de patients à traiter pour prévenir une fracture vertébrale est à peine de 13. Ces médicaments présentent donc un rapport risques-avantages qui en favorise largement l’utilisation chez les patients atteints d’ostéoporose.
Ostéonécrose de la mâchoire
La mâchoire est le siège le plus fréquent de l’ostéonécrose chez les patients qui prennent des bisphosphonates. Dans des conditions normales, le taux de renouvellement des cellules osseuses dans la mâchoire est supérieur au taux observé dans l’ensemble du squelette3. La diminution du renouvellement osseux causée par la prise de bisphosphonates réduit donc considérablement le pouvoir de régénération et de guérison des mâchoires en réponse à un traumatisme, à une extraction dentaire ou à l’usure physiologique causée par les forces occlusales. Dans son énoncé de position publié en 2007, le comité consultatif sur l’ostéonécrose de la mâchoire associée aux bisphosphonates (Advisory Task Force on Bisphosphonate-Related Osteonecrosis of the Jaws) de l’American Association of Oral and Maxillofacial Surgeons a défini l’ONMB comme un état répondant aux critères suivants : 1) exposition d’os nécrotique dans la zone maxillofaciale durant une période de plus de huit semaines; 2) prise actuelle ou antérieure de bisphosphonates et; 3) aucun antécédent de radiothérapie des mâchoires1,4-6,8-10,13,14,19. Le tableau clinique de l’ONMB varie. Ainsi, le patient peut présenter une mobilité dentaire, une inflammation des tissus mous, des trajets fistuleux, des changements neurosensoriels des lèvres ou des écoulements purulents ou, au contraire, il peut être asymptomatique5. La douleur est directement corrélée à l’infection, laquelle est révélée par une réponse inflammatoire6. La présence d’espèces d’Actinomyces14, de Moraxella et d’Eikenella a souvent été détectée dans les tissus osseux prélevés de sites d’ONMB, ce qui signifie que l’infection microbienne pourrait jouer un rôle dans l’étiologie de l’ONMB. Les examens radiographiques peuvent indiquer des changements non spécifiques comme une ostéolyse, une ostéosclérose, une lamina dura sclérotique autour des dents, un os sclérotique au-dessus de la ligne mylo-hyoïdienne, un aspect marbré de l’os dans la région des prémolaires et des molaires, une persistance de l’alvéole de l’os alvéolaire ou un élargissement du ligament parodontal14. Les facteurs précipitants de l’ONMB comprennent les extractions dentaires (dans plus de 75 % des cas), suivies des maladies parodontales, de prothèses mal ajustées et de traumatismes au niveau des tori12-14. Un âge avancé, la prise de stéroïdes, une santé fragilisée et le sexe féminin sont tous des facteurs de risque connus, ce dernier facteur étant sans doute lié au fait que les femmes représentent 70 % des patients traités avec des bisphosphonates12. Chez les utilisateurs de bisphosphonates, le risque d’ONMB suit une courbe dose-réponse et il augmente parallèlement à la fréquence d’administration14. Fait intéressant à signaler, 25 % des cas d’ostéonécrose de la mâchoire associée à des bisphosphonates i.v. sont dits spontanés6, c’est-à-dire qu’ils ne sont pas causés par un traumatisme, bien que de nombreux chercheurs croient qu’un facteur de prédisposition indétectable pourrait en fait en être le facteur étiologique (par exemple des dents cariées ou avec abcès non traitées et impossibles à restaurer ou l’élargissement des ligaments parodontaux)10. Le diagnostic différentiel inclut le plus souvent les affections suivantes : ostéite alvéolaire, sinusite, gingivite ou parodontite, pathologie périapicale et séquestre osseux mandibulaire au niveau lingual avec ulcération4,9.
Télopeptide C-terminal réticulé
Tableau 1 Intervalles de référence pour le télopeptide C-terminal (CTX) réticulé, utilisés par Quest Diagnostics (Madison, N.J.)
| Intervalles de référence du CTX (pg/mL) | ||
| Âge | Hommes | Femmes |
| Adulte | ||
| 18 à 29 ans | 87-1 200 | 60-640 |
| 30 à 39 ans | 70-780 | 60-650 |
| 40 à 49 ans | 60-700 | 40-465 |
| Pédiatrique | ||
| 5 à 9 ans | 574-1 849 | 574-1 849 |
| 10 à 13 ans | 519-2 415 | 519-2 415 |
| 14 à 17 ans | 435-2 924 | 242-1 291 |
Le marqueur biochimique sérologique le plus utilisé pour stratifier le risque d’ONMB chez les utilisateurs de bisphosphonates est le télopeptide C‑terminal (CTX) réticulé du collagène de type I1,2,5,6,10,12,18-20. Lorsque le taux de renouvellement osseux augmente, les ostéoclastes dégradent le collagène de type I, ce qui a pour effet de libérer des molécules de CTX. Le collagène de type I est l’un des principaux composants de l’os, représentant de 90 à 98 % de la matrice organique5,6. Des chercheurs ont démontré qu’il est possible de quantifier la baisse des taux sériques de CTX dans les semaines suivant le début d’un traitement aux bisphosphonates12. Bien qu’il soit scientifiquement plausible de déterminer le risque d’ONMB à partir de la valeur de CTX, certains auteurs ont établi une corrélation entre la valeur prédictive du CTX et le nombre et la taille des lésions potentielles6. Des études ont démontré que les taux de CTX peuvent diminuer de 60 % moins de six semaines après le début de l’administration de bisphosphonates aux doses habituelles12. Dans les articles retenus aux fins de la présente analyse (voir la rubrique Recensement de la littérature), les intervalles de référence des valeurs de CTX varient considérablement, certaines études utilisant un intervalle de 50 à 370 pg/mL1 et d’autres un intervalle de 115 à 1 351 pg/mL5. Quest Diagnostics (Madison, N.J.) a défini plusieurs intervalles de référence21 en fonction du sexe et de l’âge du patient (tableau 1).
Les valeurs de CTX varient selon l’âge, le sexe, la consommation de tabac, l’ovulation, la prise concomitante de médicaments, l’activité physique, le rythme circadien10, la fonction rénale3 et l’état de jeûne. À titre d’exemple, la polythérapie associant la prednisone et le méthotrexate – laquelle est largement utilisée pour le traitement de certaines maladies auto-immunes (dont le myélome multiple) – réduit encore plus l’activité des ostéoclastes et supprime le renouvellement osseux6. Bien que la plupart des études mentionnent que le dosage du CTX est fait à jeun pour réduire la variabilité des marqueurs du renouvellement osseux10, d’autres présentent des résultats obtenus chez des patients qui n’étaient pas à jeun. On croit toutefois que, comparativement à d’autres marqueurs sérologiques, les taux de CTX varient peu selon que le patient est à jeun ou non18, bien que l’on ne possède aucune donnée permettant d’établir quelque différence statistiquement significative. En fait, certains chercheurs estiment que les taux de CTX varient surtout en fonction du rythme circadien et de l’état de jeûne18.
Des fenêtres thérapeutiques de 3 à 6 mois ont été recommandées pour les patients traités avec des bisphosphonates pendant 3 ans ou plus4,6,8,9,11. De même, une fenêtre thérapeutique de 3 mois est conseillée pour les patients chez qui la prise de bisphosphonates est associée à une stéroïdothérapie, et ce, même si le traitement par les bisphosphonates est d’une durée de moins de 3 ans11. La valeur de CTX augmente de 25,9 à 26,4 pg/mL pour chaque mois de fenêtre thérapeutique10,20.
Une recherche a été faite dans la base de données PubMed (National Library of Medicine) et celle de la bibliothèque Cochrane en utilisant les mots-clés « ctx », « bisphosphonate », « osteonecrosis » et « bronj », afin de recenser les ouvrages portant sur le CTX comme variable prédictive de l’ONMB (tableau 2). Les articles retenus aux fins de l’analyse sont ceux qui répondaient aux critères suivants : article publié en 2007 ou après, études menées sur des humains et publication en anglais.
Tableau 2 Résultats du recensement de la littérature
| Base de données consultée | Mots-clés utilisés | Nombre de citations extraites | Nombre d’articles retenus par recherchea |
| PubMed (National Library of Medicine) | ctx ET bronj | 8 | 5 |
| bisphosphonate ET osteonecrosis ET ctx | 28 | 6 | |
| Web of Knowledge | Recherche de citations : Marx ET Cillo ET Ulloa ET 2007 | 1 | 1 |
| Bibliothèque Cochrane | osteonecrosis ET bisphosphonate | 11 | 1 |
| Articles extraits des références | S. O. | 4 | 4 |
S. O. = sans objet
Norme de soins
Classification du risque
Tableau 3 Tableau de stratification du risque6
| Valeur de CTX (pg/mL) | Risque attribué |
| < 100 | Élevé |
| 100 à 150 | Modéré |
| > 150 | Minimal |
a Les articles retenus aux fins de l’analyse sont ceux qui ont été publiés en 2007 ou après, qui traitaient d’études sur des humains et dont la langue de publication était l’anglais.
Marx s’est basé sur les valeurs de CTX pour répartir les patients entre les catégories de risque minimal, modéré et élevé (tableau 3)6. Cette stratification du risque est citée à maintes reprises dans la littérature sur l’ONMB et l’usage de bisphosphonates; de fait, dans plus des trois quarts des articles retenus aux fins de la présente analyse, le risque a été évalué selon le tableau de Marx. Une recherche de citations effectuée le 21 avril 2013 dans la base Web of Knowledge (Thomson Reuters; http://www.isiwebofknowledge.com) a révélé que l’article de Marx publié en 20076 avait été cité 219 fois. Depuis la publication de cet article, aucune modification n’a été apportée aux catégories de risque ou aux valeurs de CTX. Il serait donc très utile sur le plan clinique que ces données soient validées par la conduite d’études multicentriques répétées portant sur de grands échantillons.
Débat concernant l’emploi de CTX
Malgré l’emploi du CTX comme variable prédictive, de plus en plus d’auteurs mettent en doute et même réfutent la valeur du CTX comme biomarqueur prédictif de l’ONMB, ces auteurs invoquant diverses limites du CTX, notamment la variabilité interpatients, l’absence d’intervalles de référence normalisés, la variation quant à l’état de jeûne des sujets et la faible possibilité d’interprétation des valeurs de CTX associées aux bisphosphonates par voie orale et i.v. Un recensement de la littérature aux fins du présent article a permis de relever un certain nombre d’études préconisant l’emploi du dosage du CTX comme test prédictif, mais également d’autres études concluant au contraire que le CTX n’est pas un marqueur approprié. Enfin, plusieurs auteurs ont minimisé la valeur des études sur le CTX comme indicateur absolu aux fins de l’évaluation du risque selon le système de Marx6 et proposé une classification plus générale de la « zone de risque » pour les patients dont les valeurs de CTX étaient inférieures à 150 pg/mL5,12.
Résultats
Tableau 4 Résultats d’études antérieures ayant examiné la valeur prédictive du dosage du CTX
| Étude | Corrélation positive entre le CTX et l’ONMB |
Corrélation négative entre le CTX et l’ONMB |
| Bagan et coll.7 | X | |
| Borromeo et coll.3 | X | |
| Fleisher et coll.10 | X | |
| Flichy-Fernandez20 | X | |
| Kunchur et coll.12 | X | |
| Kwon et coll.18 | X | |
| Kwon et coll.19 | X | |
| Lazarovici et coll.5 | X | |
| Lee et Suzuki8 | X | |
| Marx et coll.6 | X | |
| O’Connell et coll.1 | X | |
| Oliver et Badr11 | Non déclarée | Non déclarée |
ONMB = ostéonécrose de la mâchoire associée aux bisphosphonates, CTX = dosage du télopeptide C-terminal réticulé
Parmi les articles retenus aux fins de cette publication, 11 ont évalué la valeur prédictive du CTX pour déterminer le risque d’ONMB. La plupart de ces études n’ont pu fournir de preuves d’une corrélation prédictive entre le taux de CTX et l’ONMB (tableau 4). Dans une étude ayant examiné les taux de CTX chez 23 patients atteints d’ONMB18, les auteurs ont constaté que les valeurs de CTX étaient plus faibles chez ces patients et ont donc conclu qu’il existait une corrélation positive. Ces auteurs ont recommandé le dosage du CTX et la stratification du risque pour tous les patients traités avec des bisphosphonates. Marx et ses collègues6, auteurs du tableau de stratification du risque selon la valeur de CTX, insistent eux aussi sur le dosage du CTX, attribuant à cette variable une valeur prédictive positive. De même, Kwon et ses collègues19 ont examiné les valeurs de CTX chez 18 patients atteints d’ONMB et ont établi une corrélation entre les valeurs de CTX et l’ONMB; ils n’ont toutefois pu établir de lien entre un faible taux de CTX et la gravité de l’ONMB (évaluée en fonction du nombre de lésions et de leur taille).
À l’opposé, des auteurs ayant comparé 25 patients répartis en 2 groupes (ONMB et groupe témoin) n’ont pu établir de corrélation statistiquement significative entre les taux de CTX et le nombre de cas d’ONMB7. Dans une autre étude sur 123 patients qui prenaient ou avaient pris des bisphosphonates, aucun n’a présenté de complications après une chirurgie dentaire, même si 24 de ces patients avaient obtenu un taux de CTX inférieur à 150 pg/mL10. Une autre étude, réalisée auprès de 50 patients traités avec des bisphosphonates par voie orale ou i.v. et ayant subi une chirurgie dentaire, n’a établi aucun lien positif entre le CTX et l’ONMB20, et les auteurs ont formulé la conclusion suivante : « nous doutons que le dosage du taux sérique de CTX soit utile pour déterminer le risque d’ostéonécrose chez les patients prenant des bisphosphonates oraux ». Les auteurs d’une autre étude menée auprès de 348 patients ont proposé une classification basée sur une « zone de risque » pour les patients dont le taux de CTX était inférieur à 150 pg/mL, concluant que « le dosage du CTX n’a pas de valeur prédictive de la manifestation de l’ONMB au niveau de chaque patient12 ». Une revue des lignes directrices cliniques à l’intention des patients prenant des bisphosphonates a recommandé le dosage du CTX, sans toutefois attribuer de corrélation prédictive positive entre le CTX et l’ONMB3. Une autre étude sur 163 patients a conclu que « le dosage du CTX ne constitue pas un test préopératoire valable pour évaluer avec précision le risque d’ONMB et n’est donc pas indiqué pour les patients devant subir une chirurgie buccale8 ». De même, une étude auprès de 23 patients n’a pu établir la valeur du marqueur CTX comme variable prédictive du risque d’ONMB1. Enfin, le protocole Cochrane proposé pour prévenir l’ONMB chez les utilisateurs de bisphosphonates n’inclut aucune recommandation concernant le dosage du CTX11. Certains auteurs – tout en admettant avec un haut niveau de confiance que des valeurs de CTX inférieures à 150 pg/mL augmentent sensiblement le risque d’ONMB – maintiennent que le CTX n’est pas un prédicteur certain de l’ONMB5.
À la lumière de ces résultats divergents, il ne fait aucun doute qu’on ne peut établir clairement la valeur prédictive du CTX comme marqueur biochimique du risque d’ONMB. De plus, les études examinées comportaient plusieurs limites, ayant trait notamment à leur puissance relativement faible attribuable à la petite taille des échantillons et aux différences dans l’interprétation des résultats selon qu’il s’agissait de bisphosphonates oraux ou i.v. Seulement trois des études examinées recommandaient le dosage du marqueur CTX pour prévoir le risque d’ONMB.
Discussion
L’examen des données publiées dans la littérature ne permet pas de dégager de consensus clair quant à l’efficacité du CTX comme marqueur de l’ONMB. De fait, certains chercheurs examinent actuellement des facteurs de rechange qui pourraient se révéler plus prometteurs que le CTX. Des études récentes montrent notamment qu’une preuve radiologique de l’élargissement du ligament parodontal pourrait être un facteur plus sensible que le CTX pour prévoir le risque d’ONMB 10, et d’autres chercheurs s’intéressent à différents marqueurs biochimiques, notamment à l’ostéocalcine sérique 18. Selon la littérature, il n’existe aucun marqueur unique qui permet de prévoir de façon fiable le risque d’ONMB, et ce risque doit plutôt être déterminé en tenant compte d’un ensemble de preuves. Bien que le CTX demeure plus fiable et moins variable que le N-télopeptide, la phosphatase alcaline osseuse ou la parathormone1,5,19, le traitement ne devrait pas être établi sur la base des résultats d’un seul test. Un bon jugement clinique et un examen approfondi des antécédents médicaux demeurent le moyen le plus efficace d’établir le traitement approprié. Il convient notamment de tenir compte de la voie d’administration des bisphosphonates et de la durée du traitement afin d’interpréter adéquatement les résultats du dosage du CTX. Il y a en effet un danger que les patients traités avec des bisphosphonates soient considérés comme des patients à haut risque et qu’ils aient de ce fait un accès limité aux soins, car les cliniciens sont réticents à les traiter.
Il existe toujours de nombreuses questions sans réponse quant à l’utilité du dosage du CTX, notamment en raison des différences entre les résultats obtenus à jeun et non à jeun et de l’applicabilité du test selon que les patients ont reçu des bisphosphonates par voie orale ou i.v. Notre compréhension des effets de ces médicaments continue toutefois de s’améliorer et la poursuite des recherches s’impose en vue d’établir des tests fiables qui soient à la fois sensibles et spécifiques pour déterminer le risque d’ONMB.
L’auteur
Références
- O’Connell J, Ikeagwani O, Kearns G. A role for C-terminal cross-linking telopeptide (CTX) level to predict the development of bisphosphonate-related osteonecrosis of the jaws (BRONJ) following oral surgery? Ir J Med Sci. 2012;181(2)1-6. Epub 2010 Jan 6.
- Statement by Merck Regarding FOSAMAX® (alendronate sodium) and Rare Cases of Osteonecrosis of the Jaw [communiqué de presse]. Mercks 2010 Mar 9. Disponible au : http://www.mercknewsroom.com/news/statement-merck-regarding-fosamax-alendronate-sodium-and-rare-cases-osteonecrosis-jaw
- Borromeo GL, Tsao CE, Darby IB, Ebeling PR. A review of the clinical implications of bisphosphonates in dentistry. Aust Dent J. 2011;56(1):2-9. Epub 2010 Dec 22.
- Lam DK, Sandor GK, Holmes HI, Evans AW, Clokie CM. A review of bisphosphonate-associated osteonecrosis of the jaws and its management. J Can Dent Assoc. 2007;73(5):417-22.
- Lazarovici TS, Mesilaty-Gross S, Vered I, Pariente C, Kanety H, Givol N, et al. Serologic bone markers for predicting development of osteonecrosis of the jaw in patients receiving bisphosphonates. J Oral Maxillofac Surg. 2010;68(9):2241-7.
- Marx RE, Cillo JE Jr, Ulloa JJ. Oral bisphosphonate-induced osteonecrosis: risk factors, prediction of risk using serum CTX testing, prevention, and treatment. J Oral Maxillofac Surg. 2007;65(12):2397-410.
- Bagan JV, Jimenez Y, Gomez D, Sirera R, Poveda R, Scully C. Collagen telopeptide (serum CTX) and its relationship with the size and number of lesions in osteonecrosis of the jaws in cancer patients on intravenous bisphosphonates. Oral Oncol. 2008;44(11):1088-9. Epub 2008 Apr 8.
- Lee CY, Suzuki JB. CTX biochemical marker of bone metabolism. Is it a reliable predictor of bisphosphonate-associated osteonecrosis of the jaws after surgery? Part II: a prospective clinical study. Implant Dent. 2010;19(1):29-38.
- Khan AA, Sandor GK, Dore E, et al. Canadian consensus practice guidelines for bisphosphonate associated osteonecrosis of the jaw. J Rheumatol 2008;35(7):1391-7.
- Fleisher KE, Welch G, Kottal S, Crag RG, Saxena D, Glickman RS. Predicting risk for bisphosphonate-related osteonecrosis of the jaws: CTX versus radiographic markers. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010;110(4):509-16. Epub 2010 Jul 31.
- Oliver R, Badr M. Interventions for the prevention of osteonecrosis of the jaws in patients receiving bisphosphonate therapy undergoing oral surgery (Protocol). Cochrane Database of Systematic Reviews 2010, Issue 2. Art. No.: CD008355. DOI: 10.1002/14651858.CD008355.
- Kunchur R, Need A, Hughes T, Goss A. Clinical investigation of C-terminal cross-linking telopeptide test in prevention and management of bisphosphonate-associated osteonecrosis of the jaws. J Oral Maxillofac Surg. 2009;67(6):1167-73.
- Khan AA, Rios LP, Sandor GK, Khan N, Peters E, Rahman MO, et al. Bisphosphonate-associated osteonecrosis of the jaw in Ontario: a survey of oral and maxillofacial surgeons. J Rheumatol. 2011;38(7):1396-402.
- Khan AA, Sandor GKB, Dore E, Morrison AD, Alsahli M, Amin F, et al. Bisphosphonate associated osteonecrosis of the jaw. J Rheumatol. 2009;36(3):478-90.
- Fosamax [feuillet d’emballage]. Merck & Co. Inc., Whitehouse Station, NJ; 2012. Disponible au :
- http://www.merck.com/product/usa/pi_circulars/f/fosamax/fosamax_pi.pdf (consulté le 2 mai 2013).
- Zometa [feuillet d’emballage].Novartis Pharmaceuticals Corporation. East Hanover, NJ; 2012. Disponible au : http://www.pharma.us.novartis.com/product/pi/pdf/Zometa.pdf (consulté le 2 mai 2013).
- Aredia [feuillet d’emballage].Novartis Pharmaceuticals Corporation. East Hanover, NJ; 2012.
- Disponible au : http://www.pharma.us.novartis.com/product/pi/pdf/aredia.pdf (consulté le 2 mai 2013).
- Kwon YD, Ohe JY, Kim DY, Chung DJ, Park YD. Retrospective study of two biochemical markers for the risk assessment of oral bisphosphonate-related osteonecrosis of the jaws: can they be utilized as risk markers? Clin Oral Implants Res. 2011;22(1):100-5. Epub 2010 Oct 13.
- Kwon YD, Kim DY, Ohe JY, Yoo JY, Walter C. Correlation between serum C-terminal cross-linking telopeptide of type I collagen and staging of oral bisphosphonate-related osteonecrosis of the jaws. J Oral Maxillofac Surg. 2009;67(12):2644-8.
- Flichy-Fernandez AJ, Alegre-Domingo T, Gonzalez-Lemonnier S, Balaguer-Martinez J, Peñarrocha-Diago M, Jimenez-Soriano Y, et al. Study of serum CTX in 50 oral surgical patients treated with oral bisphosphonates. Med Oral Patol Oral Cir Bucal. 2012;17(3)e367-70.
- Quest Diagnostics. Collagen Type I C-Telopeptide (CTx). [Consulté le 7 novembre 2012]. Disponible au : http://www.questdiagnostics.com/testcenter/TestDetail.action?ntc=17406.
- U.S. Department of Health & Human Services. FDA U.S. Food and Drug Administration. FDA Approves Thalomid (thalidomide) to Treat Multiple Myeloma. [Dernière mise à jour le 05/11/2009; consulté le 7 mars 2013]. Disponible au : "http://www.fda.gov/AboutFDA/CentersOffices/OfficeofMedicalProductsandTobacco/CDER/ucm095651.htm?utm_campaign=Google2&utm_source=fdaSearch&utm_medium=website&utm_term=thalomid multiple myeloma&utm_content=1.
- Denz U, Haas PS, Wasch R, Einsele H, Engelhardt M. State of the art therapy in multiple myeloma and future perspectives. Eur J Cancer. 2006;42(11):1591-600. Epub 2006 Jul 3.
- Gieseler F. Pathophysiological considerations to thrombophilia in the treatment of multiple myeloma with thalidomide and derivates. Thromb Haemost. 2008;99(6):1001-7.
- American Dental Association Council on Scientific Affairs. Dental management of patients receiving oral bisphosphonate therapy: expert panel recommendations. J Am Dent Assoc. 2006;137(8):1144-50.
Étude de cas no 1
Une femme de 82 ans qui avait des antécédents de myélome multiple et d’arthroplastie bilatérale des genoux s’est présentée pour recevoir des soins dentaires. Ses antécédents médicaux incluaient la prise de pamidronate i.v. pendant huit mois en 2010 et en 2011, pour un total de 16 mois. La patiente devait recommencer à prendre des bisphosphonates i.v. en novembre 2011, soit un mois après sa consultation pour des soins dentaires (octobre 2011). Les observations dentaires faisaient mention d’un traitement endodontique sur la dent 21 fracturée au niveau gingival (ill. 1), ainsi que d’importantes caries sur les dents 36 et 37 avec atteinte sous-osseuse (ill. 2 et 3). On a déconseillé à la patiente de subir des extractions à cause du risque d’ONMB. Le plan de traitement prévoyait un nouveau traitement endodontique sur la dent 21 avec meulage d’une partie de la racine restante en vue de la mise en place d’une prothèse partielle amovible, un traitement de canal sur les dents 36 et 37 et la mise en place, sur les racines restantes, d’un recouvrement en verre ionomère modifié à la résine. La patiente a ensuite été dirigée vers les installations de Quest Diagnostics pour un dosage du marqueur CTX, dont le résultat a été de 866 pg/mL. Selon le tableau de risque de Marx6, ce résultat correspondait à un faible risque d’ONMB. Cependant, bien qu’un taux de CTX de 866 pg/mL indique un renouvellement osseux élevé, et donc un bon potentiel de réparation ou de régénération, la prise prolongée de bisphosphonates i.v. et la reprise imminente de ce traitement laissaient croire que le risque relatif d’ONMB se situait toujours entre 6,7 % et 9,1 %, d’après la littérature3,12.
De la clindamycine (600 mg, par voie orale) a été administrée à la patiente une heure avant le traitement. Un traitement de canal a été réalisé sur la dent 21 avec l’instrument rotatif Profile GT (Tulsa/Dentsply; Tulsa, Okla.) suivi d’une obturation canalaire à l’aide de gutta-percha chaude insérée par condensation verticale (ill. 4). Les racines résiduelles s ont été recouvertes avec le matériau de reconstitution Fuji II LC CORE (GC America; Alsip, Ill.). Une prothèse partielle amovible a été fabriquée pour recouvrir la région de la racine résiduelle de la dent 21. Les lésions carieuses sur les dents 36 et 37 ont été éliminées, ce qui a nécessité le retrait complet des deux couronnes. L’hypochlorite de sodium a été remplacé par une solution de chlorhexidine à 2 % pour éviter tout débordement dans la cavité buccale. Les canaux ont été nettoyés et mis en forme avec les instruments rotatifs GT et obturés avec du Thermafil (Tulsa/Dentsply; Tulsa, Okla.) (ill. 5 et 6). Lors des visites de suivi effectuées une et deux semaines après le traitement, la patiente a indiqué que tous ses symptômes avaient disparu.
Ce cas montre que les valeurs de CTX sont insuffisantes, à elles seules, pour déterminer le traitement approprié. Ainsi, dans ce cas, il a également été impératif de tenir compte de l’usage passé et futur de bisphosphonates i.v. par la patiente pour évaluer le risque et déterminer le pronostic. La détermination du risque d’ONMB chez cette patiente n’a pas suivi la stratification du risque proposée par Marx6 (tableau 3), car la patiente aurait alors été considérée comme à très faible risque. L’auteur estime que le traitement dispensé et la décision de ne pas extraire de dents étaient appropriés, même si la patiente présentait un taux élevé de CTX.
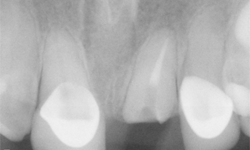 Ill. 1 : Image préopératoire de la dent 21 fracturée au niveau de la gencive.
Ill. 1 : Image préopératoire de la dent 21 fracturée au niveau de la gencive.
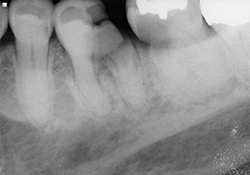
Ill. 2 et 3 : Radiographies préopératoires montrant des caries s’étendant sous le niveau de l’os sur les dents 36 et 37.
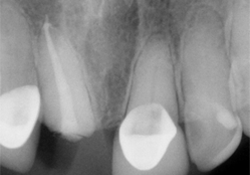 Ill. 4 : Nouveau traitement endodontique terminé sur la dent 21 avec recouvrement en résine.
Ill. 4 : Nouveau traitement endodontique terminé sur la dent 21 avec recouvrement en résine.
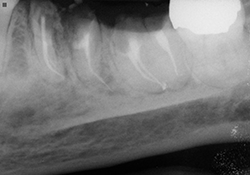
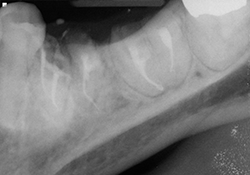
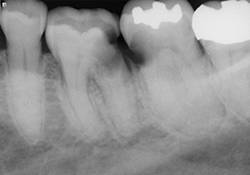
Ill. 5 et 6 : Traitements de canaux terminés avec recouvrements à l’aide de verre ionomère modifié à la résine.
Étude de cas no 2
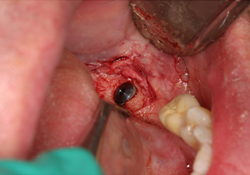
Un homme de 70 ans ayant des antécédents de myélome multiple s’est présenté pour un traitement en août 2010. Ses antécédents pharmaceutiques incluaient la prise de zolendronate i.v. pendant trois mois à partir d’août 2009. Le patient prenait également de la méthylprednisolone, un corticostéroïde, et de la thalidomide, un agent immunomodulateur, deux fois par semaine. En 2006, la Food and Drug Administration des États-Unis a approuvé l’emploi de la thalidomide en association avec un corticostéroïde pour le traitement du myélome multiple22, ce traitement permettant d’améliorer le taux de réponse de 60 à 70 % lorsqu’il était utilisé en association avec d’autres agents chimiothérapeutiques23,24. Au moment de la consultation, environ neuf mois s’étaient écoulés depuis l’interruption de la prise de zolendronate i.v. Les observations dentaires se limitaient à la mobilité d’une prothèse partielle fixe céramo-métallique sur les dents 35-X-X-38. Une carie rampante avait causé le descellement de la couronne sur le pilier distal, la dent 38, et une lésion périapicale était visible à la radiographie (ill. 1). Le traitement aurait normalement consisté en la mise en place d’implants multiples et en une augmentation de la crête aux sites des dents 36 et 37; on a toutefois jugé que ces procédures présentaient un risque trop élevé en raison des antécédents médicaux du patient. Le patient a été dirigé vers une installation locale de Quest Diagnostics pour un dosage du marqueur CTX. Ce test a révélé un taux de CTX d’à peine 31 pg/mL, même si le patient n’avait été exposé à des bisphosphonates i.v. que pendant trois mois. Selon le tableau de risque établi (tableau 3), cette faible valeur de CTX signifiait que le patient était à haut risque. Un plan de traitement modifié – incluant le sectionnement du pont (en laissant le pilier mésial 35 intact), l’extraction de la dent 38, la mise en place d’un implant unique et la fabrication d’une prothèse partielle amovible implanto-portée avec un attachement Locator (Zest Anchors; Escondido, Calif.) – a été établi. Après le sectionnement du pont et l’extraction chirurgicale de la dent 38, l’alvéole a été préservée avec le matériau MinerOss (BioHorizons IPH; Birmingham, Ala.) (ill. 2), une allogreffe composée d’un mélange de fragments d’os spongieux et d’os cortical, fixée à l’aide de la membrane de collagène Mem-Lok (BioHorizons IPH; Birmingham, Ala.). Quatre mois plus tard, un implant anatomique rainuré NobelReplace (Nobel Biocare; Zurich, Suisse) de 5 mm × 10 mm a été mis en place à 35 N/cm au site de la dent 38 (ill. 3 et 4). Une suture primaire a été réalisée, et de l’amoxicilline par voie orale (500 mg, 3 fois par jour pendant une semaine) et un rince-bouche à base de chlorhexidine à 0,12 % (2 fois par jour) ont été prescrits. La phase II (exposition de l’implant) a été réalisée quatre mois plus tard, et un attachement Locator de 5 mm × 4 mm a été mis en place. La stabilité de l’implant, mesurée selon l’échelle ISQ (quotient de stabilité de l’implant) (Osstell AB; Göteborg, Suède), a été de 74; selon le mode d’emploi du fabricant, cette valeur indiquait un implant suffisamment stable pour la restauration finale. Une prothèse partielle amovible implanto-portée a été fabriquée (ill. 5), mais le patient n’était pas à l’aise avec cette prothèse. Le plan de traitement a donc été réexaminé et il a été décidé de fabriquer une prothèse partielle fixe allant de l’implant 38 à la dent 35, en utilisant un pilier Atlantis (Atlantis Components; Cambridge, Mass.) (ill. 6 à 8).
Contrairement à l’étude de cas n0 1 où la patiente avait pris des bisphosphonates i.v. durant une longue période et présentait un taux relativement élevé de CTX, ce patient avait un faible taux de CTX alors qu’il avait été exposé à des bisphosphonates i.v. durant une période relativement courte. En se basant sur les recommandations formulées par le comité d’experts relativement aux patients traités avec des bisphosphonates (et publiées dans le Journal of American Dental Association en 2006)25, il a été décidé de mettre en place un implant unique, car on obtient habituellement une bonne ostéointégration avec ces implants et qu’il n’y a pas de contre-indication à les utiliser chez ces patients. On a jugé que l’augmentation de la crête et la mise en place d’implants multiples présentaient un risque trop élevé d’ONMB. Le faible taux de CTX pourrait également s’expliquer par l’usage concomitant de corticostéroïdes, lesquels peuvent contribuer à réduire l’activité de remodelage osseux6. Bien que le traitement dispensé puisse être considéré comme une option comportant un risque relativement élevé, l’auteur estime qu’un bon résultat clinique a été obtenu en cherchant à concilier le désir du patient d’avoir une prothèse fixe et les options de traitement limitées qui s’offraient au clinicien en raison des antécédents médicaux du patient. L’auteur estime par ailleurs que les patients qui présentent de faibles taux de CTX ne devraient pas systématiquement être classés comme des patients à « haut risque » et que les dentistes ne devraient pas non plus refuser de traiter ces patients. Dans le cas présent, une planification rigoureuse du traitement et de bonnes communications entre le patient et le dentiste ont permis d’obtenir de bons résultats.
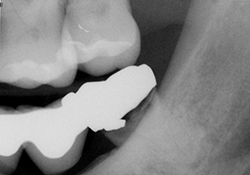 Ill. 1 : Radiographie préopératoire de la dent 38 montrant la présence d’une carie et d’une radiotransparence périapicale.
Ill. 1 : Radiographie préopératoire de la dent 38 montrant la présence d’une carie et d’une radiotransparence périapicale.
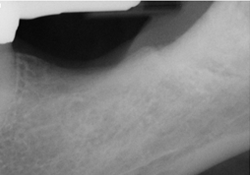 Ill. 2 : Radiographie prise quatre mois après l’extraction, montrant une bonne densité osseuse et un bon remplissage osseux.
Ill. 2 : Radiographie prise quatre mois après l’extraction, montrant une bonne densité osseuse et un bon remplissage osseux.
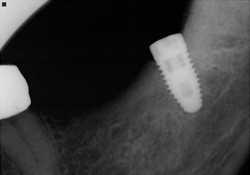
Ill. 3 et 4 : Mise en place d’un implant NobelReplace (5 mm × 10 mm) au site 38.
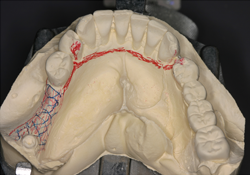 Ill. 5 : Conception de la prothèse partielle amovible implanto-portée sur le modèle.
Ill. 5 : Conception de la prothèse partielle amovible implanto-portée sur le modèle.
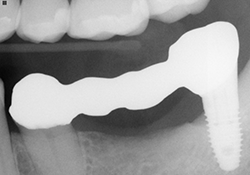 Ill. 6 : Essai en bouche de la prothèse partielle fixe du pilier Atlantis 38 à la dent 35.
Ill. 6 : Essai en bouche de la prothèse partielle fixe du pilier Atlantis 38 à la dent 35.
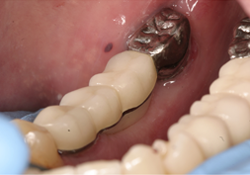
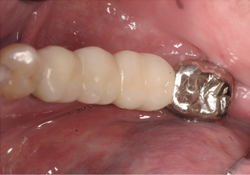
Ill. 7 et 8 : Photographies du pont scellé en place.

