Présentation du cas
Un homme de 48 ans a été dirigé vers notre service de stomatologie par un dentiste généraliste, pour l'évaluation d'une masse indolore dans les tissus mous. La lésion mesurait environ 3 cm × 2 cm et avait grossi rapidement depuis que le patient l'avait découverte 1 mois plus tôt. L'examen a révélé une tuméfaction semi-ferme légèrement douloureuse au niveau alvéolaire du maxillaire supérieur, s'étendant buccalement dans le vestibule entre les dents 23 et 26 (de la canine gauche à la première molaire gauche; ill. 1). La muqueuse qui recouvrait la tuméfaction était érythémateuse. La radiographie panoramique initiale (ill. 2) montrait une zone radioclaire diffuse dans le processus alvéolaire du maxillaire supérieur gauche, compatible avec une légère destruction de l'os alvéolaire; une mauvaise définition du plancher du sinus maxillaire; une perte de lamina dura et un abaissement du contour de l'os alvéolaire évoquant une parodontite ou des abcès parodontaux.
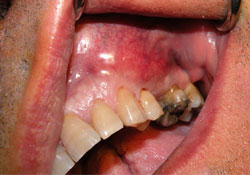 Ill. 1 : Tuméfaction dans le vestibule buccal du maxillaire supérieur gauche, recouverte d'une muqueuse érythémateuse.
Ill. 1 : Tuméfaction dans le vestibule buccal du maxillaire supérieur gauche, recouverte d'une muqueuse érythémateuse.
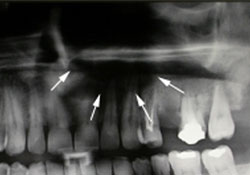 Ill. 2 : Radiographie panoramique montrant une zone radioclaire irrégulière dans le maxillaire supérieur gauche (flèches).
Ill. 2 : Radiographie panoramique montrant une zone radioclaire irrégulière dans le maxillaire supérieur gauche (flèches).
Quel est votre diagnostic?
Discussion
Les observations cliniques et radiologiques laissaient croire à une lésion agressive, un diagnostic qui a été renforcé par l'absence de maladie buccodentaire pouvant expliquer la zone radioclaire dans le processus alvéolaire. De plus, l'élargissement de l'espace du ligament parodontal dans la région de la lésion, en l'absence de maladie buccodentaire, suggérait une étiologie non liée à la dent. Le néoplasme figurait donc à un rang élevé dans le diagnostic différentiel. L'inflammation d'origine dentaire, l'infection chronique des sinus ou un pseudokyste rétentionnel muqueux ont été considérés comme moins probables.
Les analyses de sang et les examens biochimiques de routine étaient normaux, les épreuves fonctionnelles hépatiques et rénales n'ont révélé aucune anomalie et le test de dépistage du VIH a été négatif. Aucun ganglion lymphatique n'était palpable dans la région faciale et le patient n'a mentionné aucune récente perte de poids soudaine.
Une biopsie-exérèse de la lésion a été pratiquée et l'échantillon a été soumis à des analyses histologiques et immunohistochimiques. La coloration des coupes à l'hématoxyline-éosine a indiqué une infiltration des tissus conjonctifs et des fibres musculaires striées par des formations folliculaires de tailles variées, ainsi qu'un infiltrat lymphoïde néoplasique mixte constitué principalement de petites cellules clivées (centrocytes) parmi quelques larges cellules non clivées (centroblastes). Les analyses immunohistochimiques ont révélé la présence de cellules fortement positives pour les marqueurs CD79a et CD20 et négatives pour les marqueurs CD5, CD43 et CD23. L'indice de prolifération, établi par analyse immunohistochimique de la protéine Ki-67 à l'aide de l'anticorps monoclonal MIB-1, a été d'environ 60 %. Ces observations étaient compatibles avec un lymphome non hodgkinien (LNH) à cellules centrofolliculaires.
Les lymphomes sont des néoplasmes malins hétérogènes issus des lymphocytes ou de leurs précurseurs. Les lymphomes sont classés entre les lymphomes hodgkiniens (LH) et les LNH, en fonction de leurs profils histologiques et de leur comportement clinique. Les LH ne représentent que 14 % environ des lymphomes, le reste étant des LNH1. Les lymphomes de cette dernière catégorie sont beaucoup moins prévisibles que les LH et sont beaucoup plus sujets à se propager dans des sites extraganglionnaires (dans près de 25 % des cas). Dans la plupart des cas, ils sont également associés à une atteinte ganglionnaire2. Une atteinte extraganglionnaire primitive est observée dans 10 à 35 % des cas au moment du diagnostic initial et cette proportion atteint 50 % durant l'évolution de la maladie3.
Dans la cavité buccale et la région maxillofaciale, l'anneau lymphatique de Waldeyer est le siège le plus fréquent des LNH, en particulier lorsqu'il y a atteinte de la zone amygdalienne; viennent ensuite la parotide et les glandes salivaires submandibulaires2. Les glandes salivaires sublinguales ou mineures sont rarement le siège de présentation des lymphomes qui ont des manifestations cliniques1.
Les LNH peuvent être divisés en sous-types selon leur profil histologique, leur morphologie cellulaire et leurs réactions à la coloration immunohistochimique. Tous les types histologiques peuvent se manifester à l'intérieur de la cavité buccale, mais les plus répandus sont les lymphomes à grandes cellules et les petits lymphomes lymphocytiques3.
Les manifestations buccales primitives les plus fréquentes des LNH incluent une tuméfaction localisée indolore avec ou sans ulcération, le déchaussement des dents, la paresthésie et une destruction de l'os adjacent, visible à la radiographie. On confond souvent les manifestations cliniques initiales des LNH avec des processus réactionnels ou inflammatoires. Les symptômes sont comparables à ceux d'un carcinome spinocellulaire et seule la biopsie permet de les distinguer4.
Le diagnostic différentiel des LNH de la cavité buccale inclut également les processus inflammatoires odontogènes, les maladies parodontales, les tumeurs malignes des tissus mous buccaux, les tumeurs des maxillaires, les néoplasmes des glandes salivaires mineures et les maladies lymphoprolifératives bénignes telles que l'hyperplasie lymphoïde folliculaire du palais5. Les observations radiologiques ne sont pas spécifiques; elles indiquent souvent une destruction osseuse diffuse, une perte de lamina dura ou un abaissement du contour de l'os alvéolaire évoquant une parodontite ou des abcès parodontaux.
Les profils hématologiques et biochimiques des patients atteints de LNH sont habituellement normaux, bien qu'une diminution du nombre de lymphocytes circulants et du taux sérique d'albumine et une élévation du taux sérique de lactate-déshydrogénase puissent être observées6.
La biopsie des ganglions lymphatiques et des tissus est la référence pour le diagnostic des LNH. Parmi les indications d'une biopsie ganglionnaire, mentionnons la présence d'une tuméfaction importante qui persiste depuis plus de 4 à 6 semaines ou qui grossit7. Bien que l'aspiration à l'aiguille soit moins invasive, une confirmation par biopsie tissulaire est nécessaire dans la plupart des cas 8. Le diagnostic précoce d'un LNH extraganglionnaire primitif de la cavité buccale repose sur l'examen histologique. À cette fin, on devrait toujours avoir recours à la coloration de routine à l'hématoxyline-éosine des coupes tissulaires, associée à des techniques immunohistochimiques. L'immunohistochimie utilisant des coupes imprégnées de paraffine est une technique utile à des fins de diagnostic et d'investigation, car c'est celle qui allie le mieux l'immunoréactivité et la morphologie tissulaire.
La stadification du LNH est importante, à la fois pour guider le traitement et déterminer le pronostic. Le système de classification le plus utilisé à cette fin est celui d'Ann Arbor, qui tient compte du nombre de sites tumoraux (ganglionnaires et extraganglionnaires) et de leur emplacement, ainsi que de la présence ou de l'absence de symptômes B1,4.
Le diagnostic durant les premiers stades du LNH, lorsque l'atteinte ganglionnaire est minimale, est associé à de meilleurs pronostics en ce qui a trait à la survie à long terme sans récidive. Le pronostic est plus sombre dans les stades avancés de la maladie, lorsque l'atteinte ganglionnaire et extraganglionnaire est étendue.
Traitement
La prise en charge du LNH dépend du stade du lymphome (indolent, agressif ou très agressif) et du diagnostic ou du sous-type précis. Les stratégies chimiothérapeutiques incluent la monochimiothérapie (p. ex. cyclophosphamide, chlorambucil, cladribine, fludarabine ou pentostatine) et la polychimiothérapie [p. ex. cyclophosphamide–vincristine–prednisone (CVP)]9. L'utilisation de l'anticorps monoclonal anti-CD20 rituximab (R), seul ou en association, a donné des résultats hautement efficaces et améliorés dans des cas de récidives et des cas réfractaires [p. ex. avec CVP (R-CVP) et avec cyclophosphamide–doxorubicine–vincristine–prednisolone (R-CHOP)]10.
Les lymphomes très agressifs nécessitent habituellement une polychimiothérapie. Les récidives sont traitées par l'administration de doses supralétales de chimiothérapie parfois associées à une radiothérapie, suivie d'un traitement de rattrapage par cellules souches autologues.
Notre patient a subi 6 cycles de chimiothérapie, qui ont été suivis d'un traitement par R-CHOP. Après ces traitements, le patient est revenu à la clinique et nous avons observé une importante rémission de la lésion buccale.
Ce cas fait ressortir l'importance de reconnaître les pathologies inhabituelles de la cavité buccale, de poser un diagnostic précoce et de diriger rapidement le patient pour une prise en charge adéquate.
LES AUTEURS
Références
- Lu P. Staging and classification of lymphoma. Semin Nucl Med. 2005;35(3):160-4.
- Epstein JB, Epstein JD, Le ND, Gorsky M. Characteristics of oral and paraoral malignant lymphoma: a population-based review of 361 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2001;92(5):519-25.
- Lin AY, Tucker MA. Epidemiology of Hodgkin's disease and non-Hodgkin's lymphoma. In: Canellos GP, Lister TA, Sklar JL, editors. The lymphomas. Philadelphia: Saunders; 1998. p. 43-60.
- Kemp S, Gallagher G, Kabani S, Noonan V, O'Hara C. Oral non-Hodgkin's lymphoma: review of the literature and World Health Organization classification with reference to 40 cases. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2008;105(2):194-201. Epub 2007 Jun 29.
- Raut A, Huryn J, Pollack A, Zlotolow I. Unusual gingival presentation of post-transplantation lymphoproliferative disorder: a case report and review of the literature. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000;90(4):436-41.
- Ezzat AA, Ibrahim EM, El Weshi AN, Khafaga YM, AlJurf M, Martin JM, et al. Localized non-Hodgkin's lymphoma of Waldeyer's ring: clinical features, management, and prognosis of 130 adult patients. Head Neck. 2001;23(7):547-58.
- Pangalis GA, Vassilakopoulos TP, Boussiotis VA, Fessas P. Clinical approach to lymphadenopathy. Semin Oncol. 1993;20(6):570-82.
- Hehn ST, Grogan TM, Miller TP. Utility of fine-needle aspiration as a diagnostic technique in lymphoma. J Clin Oncol. 2004;22(15):3046-52.
- Peterson BA, Petroni GR, Frizzera G, Barcos M, Bloomfield CD, Nissen NI, et al. Prolonged single-agent versus combination chemotherapy in indolent follicular lymphomas: a study of the cancer and leukemia group B. J Clin Oncol. 2003;21(1):5-15.
- van Oers MH, Klasa R, Marcus RE, Wolf M, Kimby E, Gascoyne RD, et al. Rituximab maintenance improves clinical outcome of relapsed/resistant follicular non-Hodgkin lymphoma in patients both with and without rituximab during induction: results of a prospective randomized phase 3 intergroup trial. Blood. 2006;108(10):3295-301. Epub 2006 Jul 27.
