Sommaire
Le lymphome non hodgkinien (LNH) intra-osseux buccal est rare. Nous présentons 2 cas de LNH du maxillaire supérieur, qui semblaient être au départ des abcès apicaux sur des dents traitées par endodontie. Alors que les radiographies ne montraient aucun signe particulier, les biopsies tissulaires ont révélé, dans les 2 cas, la présence d’un LNH diffus à grandes cellules B. Aucune autre atteinte n’a été détectée. Les 2 patients ont été traités par chimiothérapie et radiothérapie, avec de bons résultats. Comme le LNH primitif du maxillaire supérieur peut imiter une lésion inflammatoire dentaire, il est essentiel de pratiquer une biopsie tissulaire lorsque les symptômes persistent après l’administration d’un traitement précis.
Le lymphome non hodgkinien (LNH) de la cavité buccale représente moins de 5 % des tumeurs malignes buccales1. Le LNH peut prendre naissance dans des ganglions lymphatiques ou des sites extraganglionnaires. Au moins 40 % des LNH se manifestent dans des sites extraganglionnaires, le plus souvent dans le tube digestif. Viennent ensuite la tête et le cou, et plus particulièrement les tissus lymphoïdes de l’anneau lymphatique de Waldeyer2 qui incluent le nasopharynx, les amygdales palatines, la base de la langue et l’oropharynx. Le lymphome diffus à grandes cellules B1 est le phénotype le plus souvent observé dans les sites extraganglionnaires.
Les amygdales sont le siège intrabuccal le plus répandu, suivi du palais. Les sites intra-osseux primitifs peuvent se manifester sous la forme d’une extension du maxillaire inférieur3, d’une hypertrophie du canal dentaire inférieur et du trou mentonnier4, d’une perte d’os alvéolaire ou d’une mobilité dentaire1. Ces signes peuvent également s’accompagner de tuméfaction, de douleur, d’une paresthésie de la lèvre ou d’une fracture pathologique1. Cependant, le LNH peut aussi imiter d’autres lésions pathologiques et prendre la forme, cliniquement, d’une tuméfaction gingivale5,6, d’une maladie parodontale7,8, d’une péricoronarite9, d’une radiotransparence apicale1 ou d’un abcès dentaire10. Il est donc souvent difficile de poser un diagnostic définitif.
Nous présentons 2 cas où un LNH imitant un abcès apical dans des dents traitées par endodontie a posé des difficultés diagnostiques.
Étude de cas 1
Un homme de race blanche âgé de 50 ans nous a consultés pour un abcès apical sur la dent 12, sur laquelle avait été pratiqué un traitement de canal 6 mois plus tôt. Durant cet intervalle de 6 mois, le patient avait été traité à 2 reprises par antibiothérapie pour une exacerbation aigüe. Le patient disait ressentir des engourdissements et une tuméfaction dans la région antérieure du maxillaire supérieur, entre les canines droite et gauche, sous le nez.
L’examen clinique des tissus mous n’a révélé aucune anomalie apparente. Aucun signe de fistule ni de tuméfaction associée à la dent 12 n’a été observé. Une radiographie rétroalvéolaire a révélé qu’un traitement de canal avait été pratiqué sur la dent 12, mais il n’y avait aucune radiotransparence périapicale distincte (ill. 1). De même, le panorex ne montrait aucun signe particulier (ill. 2). Une résection radiculaire a été pratiquée sous neuroleptanalgésie, et une obturation rétrograde avec un matériau de restauration temporaire de type oxyde de zinc-eugénol renforcé. a été réalisée sur la dent 12.
Durant la procédure, une importante destruction osseuse a été observée autour des apex de toutes les dents supérieures antérieures, des dents 13 à 23. De nombreux échantillons de ce qui semblait être du tissu de granulation chronique ont été prélevés à des fins d’examen pathologique. Le rapport de pathologie initial a fait mention d’un infiltrat atypique compatible avec un lymphome malin.
Des analyses immunophénotypiques plus poussées ont mené à un diagnostic définitif de LNH diffus à grandes cellules B. Une tomodensitométrie (TDM) postopératoire et une reconstruction tridimensionnelle ont confirmé la présence d’une large zone de destruction osseuse (mesurant 1,8 cm sur 2,9 cm) sur la face antérieure du maxillaire supérieur (ill. 3 et 4). La scintigraphie osseuse du corps entier et la scintigraphie au gallium ont montré une captation diffuse non spécifique dans l’ensemble du maxillaire supérieur.
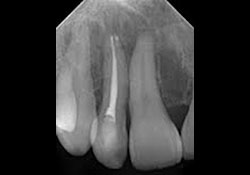 Ill. 1 : Radiographie rétroalvéolaire de la dent 12 traitée par endodontie, qui ne montre aucune radiotransparence distincte.
Ill. 1 : Radiographie rétroalvéolaire de la dent 12 traitée par endodontie, qui ne montre aucune radiotransparence distincte.
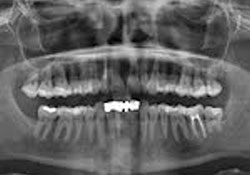 Ill. 2 : Panorex de la dent 12 ne montrant aucun caractère particulier.
Ill. 2 : Panorex de la dent 12 ne montrant aucun caractère particulier.
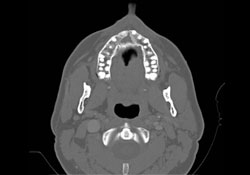 Ill. 3 : Tomodensitométrie axiale montrant une importante destruction osseuse dans la région antérieure du maxillaire supérieur.
Ill. 3 : Tomodensitométrie axiale montrant une importante destruction osseuse dans la région antérieure du maxillaire supérieur.
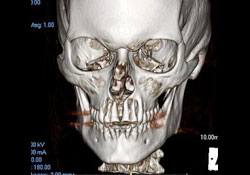 Ill. 4: Reconstruction 3D montrant une importante destruction osseuse autour des apex des incisives supérieures.
Ill. 4: Reconstruction 3D montrant une importante destruction osseuse autour des apex des incisives supérieures.
Toutes les analyses sanguines étaient normales, notamment les taux de IgG, de bêta-2-microglobuline et de lacticodéshydrogénase qui se situaient tous dans les limites de la normale. Aucune autre intervention n’a été recommandée à ce stade, mais le patient a fait l’objet de suivis réguliers par TDM. L’état clinique du patient a continué de s’améliorer après la chirurgie et le patient a affiché un bon rétablissement postopératoire.
Douze mois plus tard, les TDM des os du crâne et du massif facial ont montré que le processus lytique avec marbrure était toujours présent dans la région antérieure du maxillaire supérieur. Une nouvelle scintigraphie osseuse corps entier a révélé qu’il y avait toujours captation diffuse accrue de technétium dans l’ensemble du maxillaire supérieur, ces résultats étant inchangés par rapport à l’examen précédent. Une deuxième scintigraphie au gallium, réalisée lors de la visite de suivi à 6 mois, avait montré la même captation non spécifique dans le maxillaire supérieur.
Les TDM répétées tous les 4 mois montraient toujours une atteinte destructive au niveau du maxillaire supérieur. Les signes vitaux et les analyses sanguines du patient étaient dans les limites de la normale et le patient était par ailleurs en bonne santé.
À la demande de l’oncologue traitant, une autre biopsie de la lésion lytique siégeant dans le maxillaire supérieur antérieur a été pratiquée sous anesthésie générale. L’analyse a révélé qu’il y avait eu comblement osseux au-dessus des apex de toutes les incisives. Une zone de tissus granulomateux de 1,5 cm sur 1,0 cm, adjacente aux apex des dents 12 et 13, a toutefois été observée; ces tissus ont été excisés et envoyés pour analyse pathologique. Le rapport de pathologie a de nouveau confirmé un LNH diffus à grandes cellules B. D’autres examens, notamment une ponction de la moelle osseuse, n’ont pas révélé d’autres atteintes; il a donc été déterminé que le patient présentait un lymphome au stade IAE (tableau 1) avec atteinte osseuse du maxillaire supérieur.
Tableau 1 Système de détermination du stade des lymphomes d’Ann Arbor14
| Stade | Définition clinique |
| I | Un seul ganglion lymphatique (I) ou site extraganglionnaire (IE) |
| II | 2 ganglions lymphatiques ou plus, situés du même côté du diaphragme (II) ou avec atteinte extraganglionnaire (IIE) |
| III | Atteinte ganglionnaire des 2 côtés du diaphragme (III), incluant la rate (IIIS), ou atteinte extraganglionnaire (IIIE), ou les deux (IIIES) |
| IV | Nombreux sites extraganglionnaires |
Remarque : Chaque stade peut également se voir attribuer la lettre A et B ou pour indiquer respectivement l’absence ou la présence de symptômes constitutionnels (notamment : fièvre, sueurs nocturnes et perte de poids supérieure à 10 %).
Le patient a subi 4 cycles de chimiothérapie R-CHOP (rituximab, cyclophosphamide, chlorhydrate de doxorubicine [hydroxydaunomycine], sulfate de vincristine [oncovin] et prednisone). Par la suite, des mesures à l’insu ont été prises et le patient a subi un traitement de radiothérapie. Le patient a très bien répondu à la radiothérapie adjuvante et son état continue à s’améliorer, 15 mois après la première biopsie.
Étude de cas 2
Une femme de race blanche âgée de 31 ans a été dirigée vers un endodontiste, pour le traitement d’une tuméfaction récurrente dans la région antérieure gauche du maxillaire supérieur associée aux dents 22 et 23. Ces dents étaient non vivantes. La pulpe nécrotique a été retirée et un traitement endodontique non chirurgical a été pratiqué sur ces dents.
La patiente est revenue 2 mois plus tard, en disant n’avoir observé aucune « réelle amélioration ». Aucune observation utile n’a été relevée. La patiente continuait d’éprouver des tuméfactions à répétition et elle est revenue à nouveau 3 mois plus tard, cette fois-ci présentant des signes d’infection et une fistule. La patiente a déclaré que du pus s’était écoulé de la zone de la dent 22 et que, depuis, elle se sentait un peu mieux. À ce moment, les tests de vitalité pulpaire (test au froid et test électrique) ont révélé que les dents 21 et 24 adjacentes étaient non vivantes, même si elles n’avaient subi aucun traitement.
La patiente a été dirigée vers un chirurgien buccal et maxillofacial pour une évaluation de la zone d’intérêt. L’examen clinique a révélé la présence d’une tuméfaction ferme et sensible du vestibule labial, au-dessus des dents 22 et 23. L’examen radiographique n’a montré aucun signe particulièrement important, ni aucune radiotransparence caractéristique (ill. 5).
L’exploration de la zone a été pratiquée sous neuroleptanalgésie afin de pouvoir pratiquer, au besoin, une biopsie et une résection radiculaire avec obturation rétrograde des dents 22 et 23 avec un matériau de restauration temporaire. Durant la chirurgie, une importante destruction du cortex labial de ces 2 dents a été observée, de même qu’une érosion manifeste entre les racines des dents qui s’étendait jusqu’à la face linguale des apex radiculaires (ill. 6). De multiples fragments ont été prélevés d’une masse ferme de tissus mous granulomateux, associée à cette destruction osseuse, à des fins d’examen pathologique. Le rapport préliminaire a fait état d’un infiltrat malin évocateur d’un lymphome. D’autres consultations et analyses immunophénotypiques ont confirmé qu’il s’agissait d’un lymphome diffus à grandes cellules B.
La TDM des os du crâne et du massif facial et la reconstruction 3D de la tête étaient normales, si ce n’est la présence d’une lésion osseuse destructrice mesurant 1,6 cm sur 5 à 6 mm dans la région antérieure gauche du maxillaire supérieur (ill. 7 et 8). Les TDM du cou, du médiastin supérieur, des deux poumons et du thorax osseux étaient normales, tout comme les analyses de sang de base et les dosages des enzymes hépatiques. Il a été déterminé qu’il s’agissait d’un lymphome diffus à grandes cellules du maxillaire supérieur de stade clinique IAE (tableau 1).
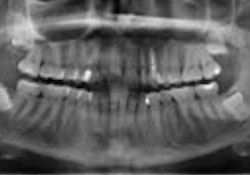 Ill. 5 : Le panorex ne montre aucune observation utile autour des dents 22 et 23.
Ill. 5 : Le panorex ne montre aucune observation utile autour des dents 22 et 23.
 Ill. 6 : Photographie intrabuccale montrant une importante destruction du cortex labial au-dessus des apex des dents 22 et 23.
Ill. 6 : Photographie intrabuccale montrant une importante destruction du cortex labial au-dessus des apex des dents 22 et 23.
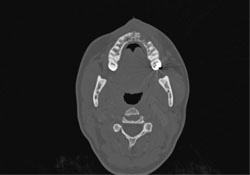 Ill. 7 : TDM axiale montrant une lésion osseuse destructrice dans la portion antérieure gauche du maxillaire supérieur.
Ill. 7 : TDM axiale montrant une lésion osseuse destructrice dans la portion antérieure gauche du maxillaire supérieur.
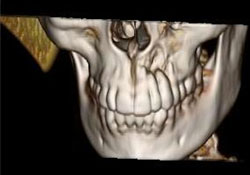 Ill. 8 : Reconstruction 3D montrant des zones localisées de destruction osseuse autour des apex des dents 22 et 23.
Ill. 8 : Reconstruction 3D montrant des zones localisées de destruction osseuse autour des apex des dents 22 et 23.
La patiente a reçu 4 cycles de chimiothérapie R-CHOP, lesquels ont été suivis d’une radiothérapie. Durant la première perfusion, la patiente a fait une réaction au rituximab, réaction qui a été maîtrisée par l’administration d’acétaminophène et de diphenhydramine (BenadrylMC). La patiente a aussi eu des nausées après le 3e cycle, qui ont été traitées par l’administration d’un aprépitant et par hydratation intraveineuse. Durant la période de rétablissement qui a suivi la radiothérapie, la patiente a présenté une dysgueusie légère à modérée due à l’utilisation d’une endoprothèse durant les traitements de radiothérapie. Quatre mois après la biopsie initiale, l’état de la patiente était dans l’ensemble bon.
Discussion
Le lymphome diffus à grandes cellules B est le LNH le plus répandu, représentant de 30 à 40 % de tous les cas11-14. Bien qu’on en connaisse peu sur les causes du LNH, les différences dans l’incidence selon le groupe ethnique laissent croire à une forte influence génétique. L’immunodéficience acquise ou congénitale est un important facteur de risque, qui pourrait être lié à une altération de la réaction immunitaire au virus Epstein-Barr15,16. Il ne fait aucun doute que des translocations chromosomiques précises jouent un rôle dans l’apparition des LNH, causant une dysrégulation des oncogènes ou des gènes suppresseurs de tumeurs et favorisant une prolifération sans entraves des cellules1.
Les tumeurs se manifestent habituellement chez des adultes d’âge moyen ou plus âgés, l’âge médian étant de 56 ans14. Au moment du diagnostic, 40 % des patients sont au stade I (atteinte d’un seul ganglion lymphatique) ou au stade II (atteinte de 2 ganglions lymphatiques situés du même côté du diaphragme) et 40 % présentent une atteinte extraganglionnaire (stade IE ou IIE), selon le système de classement des lymphomes hodgkiniens d’Ann Arbor14 (tableau 1). Le stade III indique une atteinte ganglionnaire des 2 côtés du diaphragme, alors que le stade IV se caractérise par une atteinte diffuse ou disséminée. Les lettres A et B indiquent respectivement l’absence ou la présence de symptômes constitutionnels. Aucun des 2 patients décrits précédemment ne présentait de symptômes constitutionnels et, dans les 2 cas, l’atteinte était extraganglionnaire. Il s’agissait donc de lymphomes de stade IAE.
Les lymphomes diffus à grandes cellules B représentent 85 % des lymphomes osseux des maxillaires supérieur et inférieur17,18. Dans les 2 cas présentés ici, la tumeur siégeait dans le maxillaire supérieur et était associée à une dent traitée par endodontie. Aucune radiotransparence apicale n’était apparente et les observations radiologiques étaient sans caractère particulier. Au début, les tumeurs prennent généralement la forme de l’os hôte à la radiographie, et certaines tumeurs peuvent être prises à tort pour des abcès dentaires19. En général, les bords sont mal définis à cause du caractère invasif du néoplasme. La structure interne est habituellement entièrement radiotransparente, avec quelques zones occasionnelles de radio-opacité et d’ostéoformation réactionnelle19. Les TDM montrent une destruction osseuse lytique caractéristique, avec un aspect « mité » localisé. Il y a souvent formation de nouveaux tissus osseux lamellaires dans le périoste et présence d’une masse variable de tissus mous18. Un élargissement du canal dentaire inférieur a aussi été observé4.
La biopsie, complétée d’études immunologiques des tissus, est la seule technique fiable de poser un diagnostic définitif. La tumeur consiste en des couches de larges cellules lymphoïdes qui présentent de gros noyaux vésiculaires, des nucléoles proéminents et un cytoplasme basophile abondant1,14. Comme la capacité de guérir les lymphomes diffus à grandes cellules B dépend du protocole de chimiothérapie initial, il est crucial de choisir le bon régime posologique. Ceci exige toutefois la détermination du stade de la maladie (tableau 1), ainsi qu’une anamnèse complète pour déterminer les facteurs de risque individuels.
Les analyses de routine incluent une formule sanguine complète et des analyses biochimiques du sérum, une radiographie des poumons, des TDM thoracique, abdominale et pelvienne, ainsi qu’une ponction-biopsie bilatérale de la moelle osseuse de la crête iliaque. D’autres examens, tels que l’imagerie par résonance magnétique (IRM), la scintigraphie au gallium, la lymphographie et, à l’occasion, une laparotomie abdominale, peuvent aussi être nécessaires. Les facteurs pronostiques de risque incluent l’âge (en années), le stade de la tumeur, le nombre de sites extraganglionnaires, la réponse du patient à une polychimiothérapie basée sur la doxorubicine et les taux sériques de lacticodéshydrogénase14. Le protocole R-CHOP est le plus souvent utilisé. La radiothérapie est habituellement délivrée à une dose de 40 à 50 Gy.
Chez certains patients dont les lymphomes sont indolents (cas 1), il arrive qu’aucun traitement initial ne soit indiqué. La radiothérapie et la chimiothérapie peuvent être entreprises ultérieurement, au besoin. En général, le pronostic des lymphomes indolents est sombre. Même si la survie est longue – l’intervalle moyen étant de 8 ans – on considère que ces lymphomes sont incurables.
Dans les cas de lymphomes agressifs (cas 2), 90 % des patients sont traités par polychimiothérapie et le taux de rémission est de 40 %. Chez les patients qui répondent bien à la chimiothérapie, les perspectives sont bonnes; on observe même chez certains une résolution de la maladie après un seul cycle de traitement. En revanche, le pronostic est sombre chez les personnes qui ne répondent pas au traitement, et la maladie est habituellement fatale en quelques semaines1.
Conclusion
Les dentistes devraient être attentifs aux situations cliniques qui ne répondent pas aux traitements classiques et ils devraient éviter de pratiquer de multiples procédures sans d’abord faire une biopsie, car ceci pourrait retarder le traitement de ce qui pourrait être un état néoplasique agressif. Le LNH extraganglionnaire primitif peut imiter un abcès apical associé à une dent traitée par endodontie, et ceci peut retarder le diagnostic et le début du traitement et influencer le pronostic et l’issue éventuelle.
LES AUTEURS
Références
- Regezi JA, Scuibba JJ, Jordan RC. Lymphoid lesions. In: Oral Pathology. Clinical Pathologic Correlations. 4th ed. St. Louis (MO): Saunders; 2003. p. 220-8.
- Vega F, Lin P, Medeiros LJ. Extranodal lymphomas of the head and neck. Ann Diagn Pathol. 2005;9(6):340-50.
- Kirita T, Ohgi K, Shimooka H, Okamoto M, Yamanaka Y, Sugimura M. Primary non-Hodgkin’s lymphoma of the mandible treated with radiotherapy, chemotherapy, and autologous peripheral blood stem cell transplantation. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000;90(4):450-5.
- Yamada T, Kitagawa Y, Ogasawara T, Yamamoto S, Ishii Y, Urasaki Y. Enlargement of mandibular canal without hypesthesia caused by extranodal non-Hodgkin’s lymphoma: a case report. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000;89(3):388-92.
- Payne M, al-Damouk JD. Gingival swelling as a manifestation of non-Hodgkin’s lymphoma. Br Dent J. 1993;175(8):293-4.
- Park YW. Non-Hodgkin’s lymphoma of the anterior maxillary gingival. Otolaryngol Head Neck Surg. 1998;119(1):146.
- Abdelsayed RA, Sangueza O. Refractory localized “periodontitis.” Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2002;93(4):394-8.
- Robledo J, Roach B. Diffuse large B-cell lymphoma of the oral cavity. Texas Dent J. 2010;127(3):317, 322-3.
- Dhanrajani PJ, Swaify GA, Khateery SM. Malignant lymphoma presenting as pericoronitis. A case report. Int J Oral Maxillofac Surg. 1992;21(5):295-6.
- Martinelli-Klay CP, Martinelli CR, Martinelli C, Dias JB, Cheade TC, Lombardi T. Primary extranodal non-Hodgkin lymphoma of the gingiva initially misdiagnosed as dental abscess. Quintessence Int. 2009;40(10):805-8.
- Hart S, Horsman JM, Radstone CR, Hancock H, Goepel JR, Hancock BW. Localised extranodal lymphoma of the head and neck: the Sheffield Lymphoma Group experience (1971-2000). Clin Oncol (R Coll Radiol). 2004;16(3):186-92.
- Takahashi H, Fujita S, Okabe H, Tsuda N, Tezuka F. Immunophenotypic analysis of extranodal non-Hodgkin’s lymphomas in the oral cavity. Pathol Res Pract. 1993;189(3):300-11.
- Shindoh M, Takami T, Arisue M, Yamashita T, Saito T, Kohgo T, et al. Comparison between submucosal (extra-nodal) and nodal non-Hodgkin’s lymphoma (NHL) in the oral and maxillofacial region. J Oral Pathol Med. 1997;26(6):283-9.
- Marx RE, Stern D. Neoplasms of the immune system: lymphomas, leukemias and Langerhans cell histiocytosis. In: Oral and Maxillofacial Pathology. A Rationale for Diagnosis and Treatment. Chicago: Quintessence Publishing Co.; 2003. p. 829-52.
- Corti M, Villafañe MF, Solari R, De Carolis L, Cangelosi D, Santoro J, et al. Non-Hodgkin lymphomas of the oral cavity in AIDS patients in a reference hospital of infectious diseases in Argentina: Report of eleven cases and review of the literature. J Gastrointest Cancer. 2011;42(3):143-8.
- Iamaroon A, Pongsiriwet S, Mahanupab P, Kitikamthon R, Pingtong J. Oral non-Hodgkin’s lymphomas: studies of EBV and p53 expression. Oral Dis. 2003;9(1):14-8.
- Weber AL, Rahemtullah A, Ferry JA. Hodgkin and non-Hodgkin lymphoma of the head and neck: clinical, pathologic, and imaging evaluation. Neuroimaging Clin N Am. 2003;13(3):371-92.
- Keszler A, Piloni MJ, Paparella ML, Soler Mde D, Ron PC, Narbaitz M. Extranodal oral non-Hodgkin’s lymphomas. A retrospective study of 40 cases in Argentina. Acta Odontol Latinoam. 2008;21(1):43-8.
- White SC, Pharoah MJ. Malignant diseases of the jaw. In: Oral Radiology: Principles and Interpretation. 6th ed. St. Louis (MO): Mosby; 2008. p. 421.




